题目内容
11.已知有浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )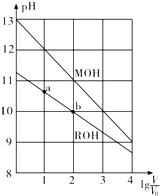
| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 | |
| D. | 若两溶液无限稀释,则它们的c(OH-)相等 |
分析 A.浓度都是0.10mol/L的这两种碱溶液未加水稀释前,MOH的pH=13,说明MOH溶液中c(OH-)=c(MON)=0.1mol/L,则MOH是强电解质;ROH溶液的pH=11,说明ROH溶液中c(OH-)<c(RON)=0.1mol/L,则ROH是弱电解质;
B.弱酸溶液中酸的浓度越小,其电离程度越大;
C.升高温度促进弱电解质电离;
D.若两溶液无限稀释,则它们水溶液接近中性.
解答 解:A.浓度都是0.10mol/L的这两种碱溶液未加水稀释前,MOH的pH=13,说明MOH溶液中c(OH-)=c(MON)=0.1mol/L,则MOH是强电解质;ROH溶液的pH=11,说明ROH溶液中c(OH-)<c(RON)=0.1mol/L,则ROH是弱电解质,所以MOH的碱性强于ROH的碱性,故A正确;
B.弱酸溶液中酸的浓度越小,其电离程度越大,a溶液浓度大于b,所以ROH的电离程度a<b,故B正确;
C.升高温度促进弱电解质电离,MOH是强电解质,升高温度不影响其电离,ROH是弱电解质,升高温度促进其电离,所以当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$减小,故C错误;
D.若两溶液无限稀释,则它们水溶液接近中性,则两种溶液中它们的c(OH-)相等,故D正确;
故选C.
点评 本题考查酸碱混合溶液定性判断及弱电解质的电离,为高频考点,侧重考查学生图象分析判断能力,明确强弱电解质判断方法、弱电解质电离影响因素、弱电解质浓度与其电离程度关系是解本题关键,注意:当酸或碱无限稀释时溶液接近中性溶液,题目难度不大.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
9.海水中含有氯化镁,从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳,②在引入海水的水渠中加石灰乳,沉降、过滤、洗涤沉淀物,③将沉淀物与盐酸反应,结晶过滤、干燥产物,④将得到的产物熔融后电解.关于提取镁,下列说法不正确的是( )
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步骤的目的是从海水中提取MgCl2 | |
| C. | 第④步电解时同时会产生氯气 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
2.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示的电解装置,可制得白色纯净的Fe(OH)2沉淀.两个电极的材料分别为石墨和铁.下列说法不正确的是( )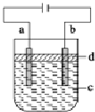

| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |
6.下列各组物质互为同系物的是( )
| A. | 红磷与白磷 | B. | 甲烷与丙烷 | C. | 乙醇与二甲醚 | D. | H、D和T |
16.室温下,用0.100mol/LNaOH溶液滴定20.00mL 0.100mol/L醋酸溶液,滴定曲线如图所示.下列说法不正确的是( )
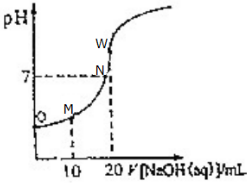

| A. | N点醋酸与NaOH恰好中和 | |
| B. | O点溶液的pH>1 | |
| C. | M点存在:2c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| D. | W点溶液中水的电离程度最大 |
3.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大.X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层电子数与其电子层数相等,Z-与M2+具有相同的核外电子层结构.下列推测正确的是( )
| A. | 原子半径Y>Z,离子半径Z-<M2+ | |
| B. | MX2与水发生反应时,MX2只做氧化剂 | |
| C. | X、Y形成的化合物既能与强酸反应又能与强碱反应 | |
| D. | MX2、MZ2两种化合物中,阳离子与阴离子个数比均为1:2 |
1.由A、B、C、D四种金属按下表中装置图进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)四种金属活泼性由强到弱的顺序是D>A>B>C.
(4)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
| 装置 | 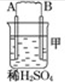 | 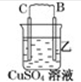 | 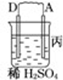 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)四种金属活泼性由强到弱的顺序是D>A>B>C.
(4)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
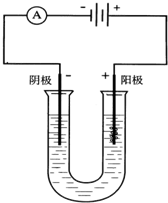 如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.
如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.