题目内容
1.由A、B、C、D四种金属按下表中装置图进行实验.| 装置 | 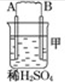 | 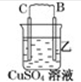 | 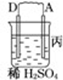 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)四种金属活泼性由强到弱的顺序是D>A>B>C.
(4)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
分析 (1)甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
(2)乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;
(3)作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C;
(4)A、C形成合金,露置在潮湿空气中,A活泼所以首先被腐蚀是A.
解答 解:(1)该装置中,二价金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A-2e-═A2+,
故答案为:A-2e-═A2+;
(2)乙装置中,明C上铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu;
(3)通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,
故答案为:D>A>B>C;
(4)A、C形成合金,露置在潮湿空气中,A活泼所以首先被腐蚀是A,故答案为:A.
点评 本题考查了原电池原理,根据原电池电极上得失电子来判断正负极,一般来说,作原电池负极的金属金属活动性顺序强,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
11.已知有浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )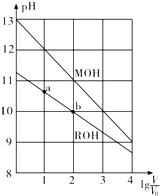

| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 | |
| D. | 若两溶液无限稀释,则它们的c(OH-)相等 |
9.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,且B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
13.下列说法正确的是( )
| A. | KW随浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
11.下列物质中,所含分子数最多的是( )
| A. | 0.4mol H2 | B. | 8.8g CO2 | ||
| C. | 6.02×1022个CH4 | D. | 4.48L NH3(标准状况下) |
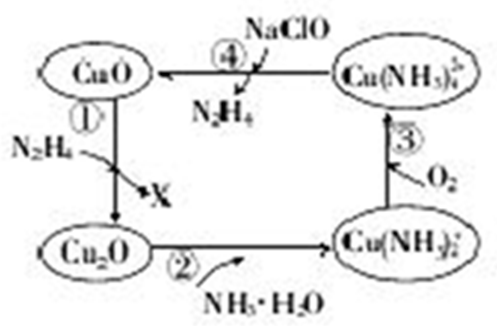
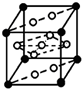 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题: .(提示:环丁烷
.(提示:环丁烷 可简写成□)
可简写成□)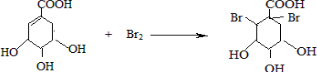 .
. ),其反应类型是消去反应.
),其反应类型是消去反应. 中任意一种.
中任意一种.