题目内容
16.室温下,用0.100mol/LNaOH溶液滴定20.00mL 0.100mol/L醋酸溶液,滴定曲线如图所示.下列说法不正确的是( )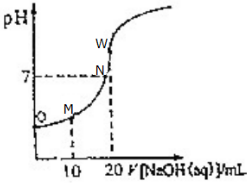
| A. | N点醋酸与NaOH恰好中和 | |
| B. | O点溶液的pH>1 | |
| C. | M点存在:2c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| D. | W点溶液中水的电离程度最大 |
分析 A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸、NaOH混合溶液呈中性,则醋酸应该稍微过量;
B.醋酸是弱电解质,在水溶液中部分电离,0.100mol/L醋酸溶液中c(H+)<0.100mol/L;
C.M点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,溶液中存在物料守恒,根据物料守恒判断;
D.W点溶液中酸碱恰好完全反应生成醋酸钠,酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸、NaOH混合溶液呈中性,则醋酸应该稍微过量,N点溶液呈中性,说明醋酸的物质的量大于NaOH物质的量,醋酸过量,故A错误;
B.醋酸是弱电解质,在水溶液中部分电离,0.100mol/L醋酸溶液中c(H+)<0.100mol/L,则醋酸的pH>1,故B正确;
C.M点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,溶液中存在物料守恒,根据物料守恒得2c(Na+)═c(CH3COO-)+c(CH3COOH),故C正确;
D.W点溶液中酸碱恰好完全反应生成醋酸钠,酸或碱抑制水电离,含有弱离子的盐促进水电离,O、M、N溶液中都含有醋酸,都抑制水电离,W点溶液中溶质为醋酸钠,促进水电离,则W点溶液中水的电离程度最大,故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析及判断能力,明确图中每一点溶液中溶质成分及其性质是解本题关键,注意:该图的中性溶液中酸碱反应的物质的量不相等、酸碱物质的量相等的混合溶液中溶液不呈中性,题目难度不大.

练习册系列答案
相关题目
14.下列物质在一定条件下可与CH4发生化学反应是( )
| A. | 氯气 | B. | 溴水 | C. | 氢气 | D. | 酸性KMnO4 |
7.用石墨作电极电解200mL一定浓度的CuSO4溶液,一段时间后停止电解,然后向电解后的溶液中加入0.1mol Cu2(OH)2CO3,可使溶液完全恢复至电解前的浓度和体积,则电解过程中电路通过电子的物质的量是( )
| A. | 0.4 mol | B. | 0.6 mol | C. | 0.8 mol | D. | 1.0 mol |
4.下列说法中正确的是( )
| A. | 煤的气化和液化是物理变化 | |
| B. | 煤的干馏是化学变化 | |
| C. | 石油裂解的目的是为了提高轻质油的产量和质量 | |
| D. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 |
11.已知有浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )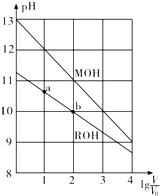

| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 | |
| D. | 若两溶液无限稀释,则它们的c(OH-)相等 |
1.下列说法正确的是( )
| A. | 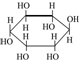 与丙三醇互为同系物 与丙三醇互为同系物 | |
| B. | 高聚物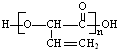 与 与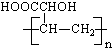 的单体相同 的单体相同 | |
| C. | 按系统命名法,化合物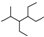 的名称为2-甲基-3,4-乙基己烷 的名称为2-甲基-3,4-乙基己烷 | |
| D. | 等物质的量的甲烷和乙酸完全燃烧时,耗氧量相等,生成的CO2的量也相等 |
5.下列各组物质中,肯定互为同系物的是( )
| A. | C2H6 C3H8 | B. | CH3COOH CH3COOCH3 | ||
| C. | C3H4 C4H6 | D. |  |
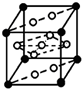 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题: