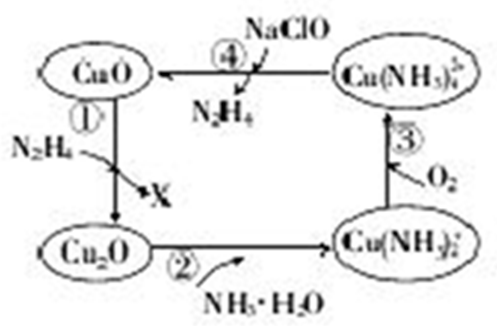
题目内容
2.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示的电解装置,可制得白色纯净的Fe(OH)2沉淀.两个电极的材料分别为石墨和铁.下列说法不正确的是( )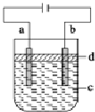
| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |
分析 A.因为Fe(OH)2极易被氧化,为防止Fe(OH)2被氧化,用电解原理制取Fe(OH)2,应该用Fe作阳极、石墨作阴极;
B.Fe(OH)2极易被氧化,所以制取Fe(OH)2时要隔绝空气;
C.阳极上生成的Fe 2+和阴极生成的OH-或溶液中OH-反应生成Fe(OH)2;
D.气体摩尔体积与温度、压强有关,温度和压强未知导致气体摩尔体积未知.
解答 解:A.因为Fe(OH)2极易被氧化,为防止Fe(OH)2被氧化,用电解原理制取Fe(OH)2,应该用Fe作阳极、石墨作阴极,则Fe作a电极、石墨作b电极,故A正确;
B.Fe(OH)2极易被氧化,所以制取Fe(OH)2时要隔绝空气,苯和水不互溶且密度小于水,所以d为苯能隔绝空气,故B正确;
C.阳极上生成的Fe 2+和阴极生成的OH-或溶液中OH-反应生成Fe(OH)2,所以电解质溶液可以是NaCl溶液、NaOH溶液等,故C正确;
D.气体摩尔体积与温度、压强有关,温度和压强未知导致气体摩尔体积未知,则无法计算阴极生成气体体积,故D错误;
故选D.
点评 本题以Fe(OH)2的制备为载体考查电解原理,为高频考点,侧重考查学生获取信息并灵活运用信息解答问题能力,涉及气体摩尔体积适用条件、电极材料的判断等知识点,明确电解原理、物质性质及气体摩尔体积适用条件是解本题关键,易错选项是D.

练习册系列答案
相关题目
20.2016年是门捷列夫诞辰182周年.下列事实用元素周期律不能解释的是( )
| A. | 沸点:H2O>H2S | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
5.下列各组离子在溶液中能大量共存,加入Fe2(SO4)3后仍能大量共存的是( )
| A. | Na+、I-、CO${\;}_{3}^{2-}$、ClO- | B. | Fe2+、H+、K+、NO${\;}_{3}^{-}$ | ||
| C. | Ba2+、Na+、SCN-、Cl- | D. | Cu2+、Fe2+、Cl-、NO${\;}_{3}^{-}$ |
7.用石墨作电极电解200mL一定浓度的CuSO4溶液,一段时间后停止电解,然后向电解后的溶液中加入0.1mol Cu2(OH)2CO3,可使溶液完全恢复至电解前的浓度和体积,则电解过程中电路通过电子的物质的量是( )
| A. | 0.4 mol | B. | 0.6 mol | C. | 0.8 mol | D. | 1.0 mol |
14.常温下,等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙.下列判断合理的是( )
| A. | 甲一定是强碱 | B. | 乙一定是弱碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
11.已知有浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )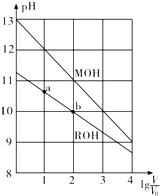

| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 | |
| D. | 若两溶液无限稀释,则它们的c(OH-)相等 |
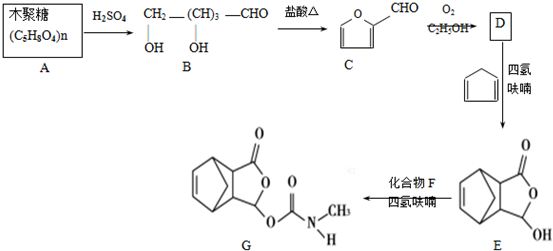
 ,在流程中作反应的催化剂;
,在流程中作反应的催化剂; ;
;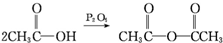 .
. 、CH3NHCOOH.
、CH3NHCOOH. .
. .
.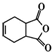 )是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用):
)是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用): .
.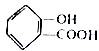
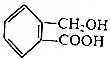 互为同系物
互为同系物 ,请写出将
,请写出将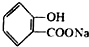 的化学方程式
的化学方程式