题目内容
14.只改变一个条件,则下列对图象的解读正确的是( )| A. | 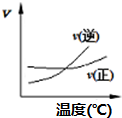 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 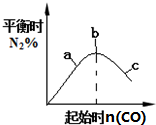 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. | 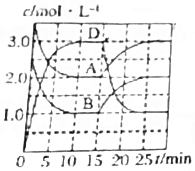 A(g)+B(g)?C(s)+2D(g)△H>0如说明反应至15min时,改变的条件是升高温度 | |
| D. | 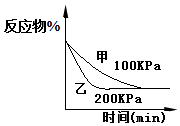 2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
分析 A.根据图可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,据此判断;
B.增加一种反应物的量会增大另一种反应物的转化率;
C.正反应放热,升高温度,平衡正向移动;
D.根据图示可以看出压强只能改变反应速率但是不改变平衡的移动.
解答 解:A.根据图可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,升高温度平衡向吸热反应移动,故可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应,故A错误;
B.根据反应原理方程式,增加一种反应物NO的量会增大另一种反应物二氧化氮的转化率,则NO2的转化率c>b>a,故B错误;
C.正反应放热,升高温度,平衡正向移动,则A、B的浓度逐渐减小,D的浓度逐渐增大,故C错误;
D.根据图示可以看出压强只能改变反应速率但是不改变平衡的移动,所以反应是前后气体的系数和相等的反应,即D一定是气体,故D正确.
故选D.
点评 本题考查了化学平衡移动原理的应用、影响反应速率的因素,题目难度中等,注意把握图象中数据的含义,明确图象中包含的信息以及利用化学平衡移动原理解决有关问题是解答该题的关键,侧重于考查学生的分析能力和读图能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.常温下,溶液的pH最大的是( )
| A. | 0.02mol•L-1氨水与水等体积混合后的溶液 | |
| B. | pH=2的盐酸与pH=12的NaOH溶液等体积混合后的溶液 | |
| C. | 0.02mol•L-1盐酸与0.02mol•L-1氨水等体积混合后的溶液 | |
| D. | 0.01mol•L-1盐酸与0.03mol•L-1氨水等体积混合后的溶液 |
5.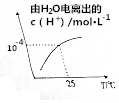 某溶液中由水电离出的c(H+)随温度的变化如图所示,则该溶液可能为( )
某溶液中由水电离出的c(H+)随温度的变化如图所示,则该溶液可能为( )
 某溶液中由水电离出的c(H+)随温度的变化如图所示,则该溶液可能为( )
某溶液中由水电离出的c(H+)随温度的变化如图所示,则该溶液可能为( )| A. | 稀硫酸 | B. | NaCl溶液 | C. | NH4NO3溶液 | D. | Ba(OH)2溶液 |
2.含FeS2 A%的黄铁矿ωg,在接触法制硫酸的过程中,损失硫C%,可制得质量分数为B%的硫酸的质量为( )
| A. | $\frac{49ωA(100-C)}{3000B}$g | B. | $\frac{40ω•C%}{30}$g | C. | $\frac{49ωA(1-C%)}{30B}$g | D. | $\frac{30ωA•C%}{49B}$g |
9.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向左移动 | |
| B. | 加入少量NaOH固体,平衡向右移动 | |
| C. | 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向右移动 |
19.下列溶液能用玻璃瓶盛放,但不能用玻璃塞的是( )
| A. | Na2SiO3溶液 | B. | HF溶液 | C. | NaNO3溶液 | D. | NaCl溶液 |
6.向1.00L0.3mol•L-1的NaOH溶液中通入4.48L(标准状况下)CO2气体,恰好完全反应,对反应后溶液的叙述中,错误的是( )
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) | |
| D. | c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
3.下列叙述正确的是( )
| A. | 所有的醇都能与水以任意比互溶 | |
| B. | 醇和酚具有相同的官能团--羟基(-OH),因而具有相同的化学性质 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点低于烷烃的沸点 | |
| D. | 苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性 |
7. 图是某有机物分子的比例模型(填充模型),其中“○”表示氢原子,“●”表示碳原子,“
图是某有机物分子的比例模型(填充模型),其中“○”表示氢原子,“●”表示碳原子,“ ”表示氧原子,该有机物的结构简式是( )
”表示氧原子,该有机物的结构简式是( )
 图是某有机物分子的比例模型(填充模型),其中“○”表示氢原子,“●”表示碳原子,“
图是某有机物分子的比例模型(填充模型),其中“○”表示氢原子,“●”表示碳原子,“ ”表示氧原子,该有机物的结构简式是( )
”表示氧原子,该有机物的结构简式是( )| A. | CH3CH3 | B. | CH2=CH2 | C. | CH3COOH | D. | CH3CH2OH |