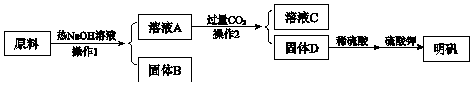
题目内容
16.常温下,溶液的pH最大的是( )| A. | 0.02mol•L-1氨水与水等体积混合后的溶液 | |
| B. | pH=2的盐酸与pH=12的NaOH溶液等体积混合后的溶液 | |
| C. | 0.02mol•L-1盐酸与0.02mol•L-1氨水等体积混合后的溶液 | |
| D. | 0.01mol•L-1盐酸与0.03mol•L-1氨水等体积混合后的溶液 |
分析 A.混合液中氨水的浓度约为0.01mol/L,溶液呈碱性;
B.反应后溶质为氯化钠,溶液的pH=7;
C.反应后溶质为氯化铵,铵根离子部分水解溶液呈弱酸性;
D.反应后溶质为0.005mol/L的氯化铵和0.01mol/L的一水合氨,溶液呈碱性,铵根离子抑制了一水合氨的电离,溶液的碱性小于A.
解答 解:A.0.02mol•L-1氨水与水等体积混合后的溶液,混合液中氨水的浓度约为0.01mol/L,溶液呈碱性;
B.pH=2的盐酸与pH=12的NaOH溶液等体积混合后的溶液,HCl和NaOH都是强电解质,反应后溶质为NaC,溶液的pH=7;
C.0.02mol•L-1盐酸与0.02mol•L-1氨水等体积混合后的溶液,反应后溶质为氯化铵,铵根离子部分水解溶液呈弱酸性,溶液的pH<7;
D.0.01mol•L-1盐酸与0.03mol•L-1氨水等体积混合后的溶液,反应后溶质为0.005mol/L的氯化铵和0.01mol/L的一水合氨,溶液呈碱性,溶液的铵根离子抑制了一水合氨的电离,溶液的碱性小于A;
根据分析可知,溶液碱性较强的为A,
故选A.
点评 本题考查了溶液酸碱性与溶液pH的关系,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电离平衡较强影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
6.1669年德围炼金术士H•布兰德将砂子、木炭、生石灰、尿液混合,加热蒸馏,得到一种类似白蜡的物质,在空气中发出冷光.已知该物质所的组成元素与氮同主族,则有关该元素的说法正确的是( )
| A. | 该元素最高价氧化物对应水化物的酸强于硝酸 | |
| B. | 该元素最高价含氧酸的钠盐(正盐)能够促进水的电离 | |
| C. | 该元素形成的氢化物的沸点高于氨气 | |
| D. | 该元素在地壳中的含量大于硅元素 |
7.下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 制取Fe(OH)3胶体 | 往盛有沸水的烧杯中滴加饱和FeCl3溶液,继续煮沸并用玻璃棒不断搅拌 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体分液漏斗上端管口倒出 |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法不正确的是( )
| A. | 葡萄糖溶液能产生丁达尔效应 | |
| B. | 为除去乙醇中混有的少量乙酸,可加足量生石灰后再蒸馏 | |
| C. | 乙烯使溴的四氯化碳溶液褪色的原因是乙烯和溴发生了加成反应 | |
| D. | 粮食酿造的酒在一定温度下密闭储存会变得更醇香,是因为生成了酯类物质 |
11.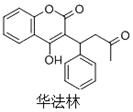 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )| A. | 分子中2个苯环一定处于同一平面 | |
| B. | 1mol华法林最多能与2mol NaOH反应 | |
| C. | 在一定条件下,华法林可与HCHO发生缩聚反应 | |
| D. | 在NaOH水溶液中加热,华法林可发生消去反应 |
13.某溶液中只可能含有下列离子中的某几种:K+、NH4+、Ba2+、SO42-、I-、AlO2-,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色.为确定该溶液的组成,还需检验的离子是( )
| A. | Ba2+ | B. | SO42- | C. | K+ | D. | NH4+ |
14.只改变一个条件,则下列对图象的解读正确的是( )
| A. | 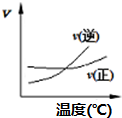 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 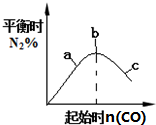 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. | 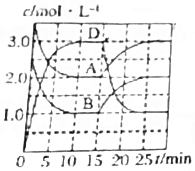 A(g)+B(g)?C(s)+2D(g)△H>0如说明反应至15min时,改变的条件是升高温度 | |
| D. | 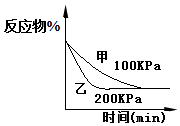 2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |