题目内容
6.向1.00L0.3mol•L-1的NaOH溶液中通入4.48L(标准状况下)CO2气体,恰好完全反应,对反应后溶液的叙述中,错误的是( )| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) | |
| D. | c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
分析 1.00L0.3mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:0.3mol/L×1L=0.3mol,标准状况下4.48L二氧化碳的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据反应CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3可知,反应后生成碳酸钠、碳酸氢钠的混合物,且二者的物质的量相等,据此结合电荷守恒、物料守恒进行判断.
解答 解:1.00L0.3mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:0.3mol/L×1L=0.3mol,标准状况下4.48LCO2的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据反应CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3可知,反应后生成碳酸钠、碳酸氢钠的混合物,且二者的物质的量相等,
A.碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故A正确;
B.反应后生成等浓度的碳酸钠和碳酸氢钠,根据混合液中的物料守恒可得:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),故B错误;
C.根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),整理可得:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故C正确;
D.溶液中存在物料守恒①2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),电荷守恒②c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据②×2-①可得:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,根据反应物的量正确判断反应产物为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 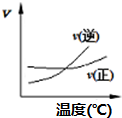 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 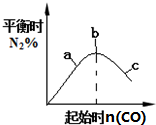 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. | 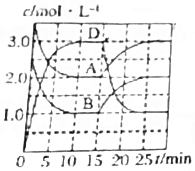 A(g)+B(g)?C(s)+2D(g)△H>0如说明反应至15min时,改变的条件是升高温度 | |
| D. | 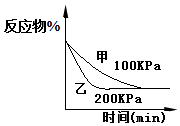 2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
| A. | 50℃、101kPa下46gNO2与0℃、101kPa下46gN2O4均含有1.806×1024个原子 | |
| B. | 100mL3mol•L-1的硫酸与100mLH2O混合,硫酸的物质的量浓度变为1.5mol•L-1 | |
| C. | 标准状况下,11.2LCH3CH2OH中含有3.01×1023个分子 | |
| D. | 在MnO2的作用下,1molH2O2充分反应转移1.204×1024个电子 |
| A. | HCl | B. | NaHSO4 | C. | CO2 | D. | Na2CO3 |
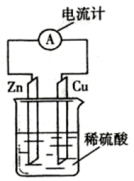
| A. | 电子由铜片通过导线流向锌片 | |
| B. | 锌片为负极,且锌片逐渐浓解 | |
| C. | 铜为正极,铜不易失电了而受到保护 | |
| D. | 该装置能将化学能抟变为电能 |
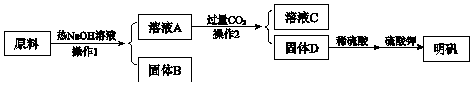
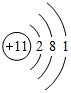 .
.