题目内容
2.含FeS2 A%的黄铁矿ωg,在接触法制硫酸的过程中,损失硫C%,可制得质量分数为B%的硫酸的质量为( )| A. | $\frac{49ωA(100-C)}{3000B}$g | B. | $\frac{40ω•C%}{30}$g | C. | $\frac{49ωA(1-C%)}{30B}$g | D. | $\frac{30ωA•C%}{49B}$g |
分析 根据工业制硫酸的三步反应化学方程式,可以建立硫元素守恒的对应关系,即硫元素全部转化为硫酸的对应关系,以此进行分析计算.
解答 解:发生的反应为 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2、2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3、H2O+SO3═H2SO4,依据反应得到硫元素与硫酸的对应关系:2S~FeS2~2SO2~2SO3~2H2SO4,
含FeS2 A%的黄铁矿ωg中含硫元素质量为:ωg×A%×$\frac{32×2}{120}$=$\frac{8ωA}{1500}$g,
在用接触法制硫酸的过程中,损失硫C%,反应转化为硫酸的硫元素利用了(1-C%),
实际反应转化为硫酸的硫元素的质量为:$\frac{8ωA}{1500}$g×(1-C%),
依据对应关系进行定量计算,设可制得浓度为B%的硫酸为xg,则:
S~H2SO4
32 98
$\frac{8ωA}{1500}$g×(1-C%) x×B%
则:x=$\frac{49ωA(1-C%)}{30B}$g=$\frac{49ω(100-C)}{3000B}$g,
故选AC.
点评 本题考查了化学方程式的计算,题目难度中等,正确分析质量分数、损失率等概念为解答关键,注意掌握关系式法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
4.下列说法不正确的是( )
| A. | 葡萄糖溶液能产生丁达尔效应 | |
| B. | 为除去乙醇中混有的少量乙酸,可加足量生石灰后再蒸馏 | |
| C. | 乙烯使溴的四氯化碳溶液褪色的原因是乙烯和溴发生了加成反应 | |
| D. | 粮食酿造的酒在一定温度下密闭储存会变得更醇香,是因为生成了酯类物质 |
13.某溶液中只可能含有下列离子中的某几种:K+、NH4+、Ba2+、SO42-、I-、AlO2-,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色.为确定该溶液的组成,还需检验的离子是( )
| A. | Ba2+ | B. | SO42- | C. | K+ | D. | NH4+ |
10.有关热稳定性强弱的比较,不正确的是( )
| A. | KClO3<KCl | B. | K2MnO4>KMnO4 | C. | NaHCO3>Na2CO3 | D. | CaCO3<CaO |
14.只改变一个条件,则下列对图象的解读正确的是( )
| A. | 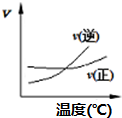 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 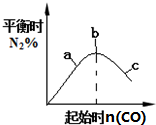 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. | 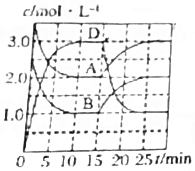 A(g)+B(g)?C(s)+2D(g)△H>0如说明反应至15min时,改变的条件是升高温度 | |
| D. | 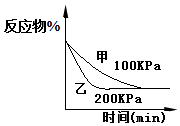 2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
12.下列选项中不能说明硫元素的非金属性强于碳元素的是( )
| A. | 硫酸酸性强于碳酸 | |
| B. | 硫与氢气加热到500℃生成H2S,碳与氢气隔绝空气加热到1200℃生成CH4 | |
| C. | CS2中硫显示-2价 | |
| D. | 硫位于ⅥA族,碳位于ⅣA族 |
 .
.