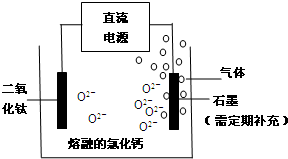
题目内容
查文献知,CH3COOH、H3PO3、H3PO4三种酸所有的逐级电离常数如下:用化学用语回答下列问题:
(1)上述三种酸中,酸性最强的是 ;
(2)常温下,在NaH2PO3稀溶液中:c(H3PO3)<c(HPO3 2-),则该溶液pH 7;(填“>”“<”或“=”)
(3)等温度、等浓度的NaH2PO4溶液与Na2HPO4溶液比较,c(H3PO4)较大的是: ;
(4)25℃时,浓度均为0.01mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液,pH最大的是: ;
(5)写出少量H3PO4溶液与CH3COONa溶液混合后,反应的离子方程式: ;
(6)等温度、等浓度的NaH2PO3溶液与NaH2PO4溶液中,粒子间存在等量关系:c(H3PO3)+ =3c(PO43-)+ -c(H+ ).(用对应溶液中其它粒子浓度补充完整)
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H3PO4 | K1=7.11×10-3 |
| H3PO3 | K1=3.7×10-2 | K2=6.23×10-8 | |
| K2=2.9×10-7 | K3=4.5×10-13 |
(2)常温下,在NaH2PO3稀溶液中:c(H3PO3)<c(HPO3 2-),则该溶液pH
(3)等温度、等浓度的NaH2PO4溶液与Na2HPO4溶液比较,c(H3PO4)较大的是:
(4)25℃时,浓度均为0.01mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液,pH最大的是:
(5)写出少量H3PO4溶液与CH3COONa溶液混合后,反应的离子方程式:
(6)等温度、等浓度的NaH2PO3溶液与NaH2PO4溶液中,粒子间存在等量关系:c(H3PO3)+
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)酸的电离常数越大,该酸的酸性越强;
(2)NaH2PO3稀溶液中,c(H3PO3)<c(HPO3 2-),则H2PO3-的电离程度大于水解程度;
(3)NaH2PO4在溶液中存在一步水解,Na2HPO4在溶液中存在两步水解,第一步水解生成的氢氧根离子对第二步水解起到抑制作用;
(4)盐的水解程度越大,对应盐的碱性越强;
(5)醋酸的电离常数大于H3PO4的第二电离常数,小于H3PO4的第一电离常数,据此判断反应产物;
(6)根据溶液中的物料守恒和质子守恒分析.
(2)NaH2PO3稀溶液中,c(H3PO3)<c(HPO3 2-),则H2PO3-的电离程度大于水解程度;
(3)NaH2PO4在溶液中存在一步水解,Na2HPO4在溶液中存在两步水解,第一步水解生成的氢氧根离子对第二步水解起到抑制作用;
(4)盐的水解程度越大,对应盐的碱性越强;
(5)醋酸的电离常数大于H3PO4的第二电离常数,小于H3PO4的第一电离常数,据此判断反应产物;
(6)根据溶液中的物料守恒和质子守恒分析.
解答:
解:(1)酸的电离常数越大,该酸的酸性越强,由表中数据可知H3PO3的电离常数最大,则H3PO3的酸性最强,故答案为:H3PO3;
(2)NaH2PO3稀溶液中,c(H3PO3)<c(HPO3 2-),则H2PO3-的电离程度大于水解程度,所以溶液显酸性,则溶液的pH<7,故答案为:<;
(3)NaH2PO4在溶液中存在一步水解,水解生成H3PO4,Na2HPO4在溶液中存在两步水解,第一步水解生成的氢氧根离子对第二步水解起到抑制作用,而且第二步水解的产物为H3PO4,由于第二步水解受到抑制,则生成的H3PO4较少;则NaH2PO4中c(H3PO4)较大,故答案为:NaH2PO4;
(4)盐的水解程度越大,对应盐的碱性越强,浓度均为0.01mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液中Na3PO4的水解程度最大,则溶液的碱性最强,则pH最大的是Na3PO4,故答案为:Na3PO4;
(5)醋酸的电离常数大于H3PO4的第二电离常数,小于H3PO4的第一电离常数,则H3PO4与CH3COONa溶液反应生成H2PO4-和CH3COOH,则反应的离子方程式为:H3PO4+CH3COO-=H2PO4-+CH3COOH,
故答案为:H3PO4+CH3COO-=H2PO4-+CH3COOH;
(6)等温度、等浓度的NaH2PO3溶液与NaH2PO4溶液中,物料守恒为c(H3PO3)+c(H2PO3-)+c(HPO32-)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-),
溶液中质子守恒为:c(H3PO3)+c(H3PO4)+c(H+)=2c(PO43-)+c(HPO42-)+c(HPO32-)+c(OH-),
则两个式子相加得:2c(H3PO3)+c(H2PO3-)=3c(PO43-)+c(H2PO4-)+2c(HPO42-)-+c(OH-)-c(H+),
故答案为:c(H2PO3-);c(H2PO4-)+2c(HPO32-)+c(OH-).
(2)NaH2PO3稀溶液中,c(H3PO3)<c(HPO3 2-),则H2PO3-的电离程度大于水解程度,所以溶液显酸性,则溶液的pH<7,故答案为:<;
(3)NaH2PO4在溶液中存在一步水解,水解生成H3PO4,Na2HPO4在溶液中存在两步水解,第一步水解生成的氢氧根离子对第二步水解起到抑制作用,而且第二步水解的产物为H3PO4,由于第二步水解受到抑制,则生成的H3PO4较少;则NaH2PO4中c(H3PO4)较大,故答案为:NaH2PO4;
(4)盐的水解程度越大,对应盐的碱性越强,浓度均为0.01mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液中Na3PO4的水解程度最大,则溶液的碱性最强,则pH最大的是Na3PO4,故答案为:Na3PO4;
(5)醋酸的电离常数大于H3PO4的第二电离常数,小于H3PO4的第一电离常数,则H3PO4与CH3COONa溶液反应生成H2PO4-和CH3COOH,则反应的离子方程式为:H3PO4+CH3COO-=H2PO4-+CH3COOH,
故答案为:H3PO4+CH3COO-=H2PO4-+CH3COOH;
(6)等温度、等浓度的NaH2PO3溶液与NaH2PO4溶液中,物料守恒为c(H3PO3)+c(H2PO3-)+c(HPO32-)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-),
溶液中质子守恒为:c(H3PO3)+c(H3PO4)+c(H+)=2c(PO43-)+c(HPO42-)+c(HPO32-)+c(OH-),
则两个式子相加得:2c(H3PO3)+c(H2PO3-)=3c(PO43-)+c(H2PO4-)+2c(HPO42-)-+c(OH-)-c(H+),
故答案为:c(H2PO3-);c(H2PO4-)+2c(HPO32-)+c(OH-).
点评:本题考查了弱酸的电离平衡常数、盐的水解原理的应用、混合溶液中离子浓度关系等,题目侧重于考查有关原理的应用,题目难度中等,注意把握溶液中的守恒关系.

练习册系列答案
相关题目
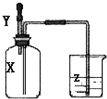 如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )
如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )| ① | X是甲烷,Y是高锰酸钾溶液,Z水 |
| ② | X是HCl,Y是浓硫酸,Z溴水 |
| ③ | X是氨气,Y是盐酸,Z浓氢氧化钠溶液 |
| ④ | X是SO2,Y是氢氧化钠溶液,Z浓硫酸 |
| A、①② | B、②④ | C、③④ | D、②③ |
在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
| A、在5 min 内该反应用C的浓度变化表示的反应速率为0.02 mol/(L?min) |
| B、5 min 时,容器内D的浓度为0.2 mol/L |
| C、该可逆反应随反应的进行,容器内压强逐渐增大 |
| D、5 min时容器内气体总的物质的量为3 mol |
参照反应Br2+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是( )
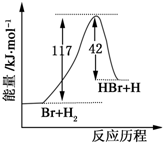

| A、反应物具有的总能量大于生成物具有的总能量 |
| B、正反应为吸热反应 |
| C、逆反应为吸热反应 |
| D、从图中可看出,该反应的反应热与反应途径有关 |
一定条件下,向含HNO3的废水中加入CH3OH进行污水处理,发生反应5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,下列说法正确的是( )
| A、CH3OH被氧化,表现氧化性 |
| B、此条件下还原性强弱为:N2>CH3OH |
| C、若氧化产物比还原产物多0.2mol,则该反应中转移3mol |
| D、该反应过程中断裂的化学键既有极性键又有非极性键 |