题目内容
常温下钛的化学活性很小,在较高温度下可与多种物质反应.
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
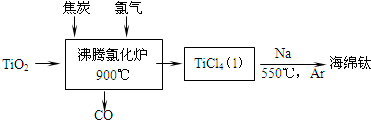
①沸腾氯化炉中发生的主要反应为: .
②已知:Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ?mol-1;2Na(s)+Cl2(g)=2NaCl(s)△H=b kJ?mol-1;Na(s)=Na(l)△H=c kJ?mol-1;则:TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)△H= kJ?mol-1.
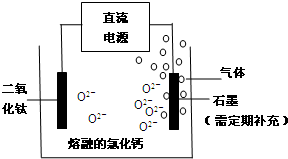
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电源 极,该极电极反应为: .但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种无毒的还原性气体,该气体是 .
(3)海绵钛可用碘提纯,原理为:,下列说法正确的是 .
A.该反应正反应的△H>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2可循环利用.
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

①沸腾氯化炉中发生的主要反应为:
②已知:Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ?mol-1;2Na(s)+Cl2(g)=2NaCl(s)△H=b kJ?mol-1;Na(s)=Na(l)△H=c kJ?mol-1;则:TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电源

(3)海绵钛可用碘提纯,原理为:,下列说法正确的是
A.该反应正反应的△H>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2可循环利用.
考点:金属的回收与环境、资源保护,电极反应和电池反应方程式
专题:实验设计题,元素及其化合物
分析:(1)①根据沸腾炉中流程可知反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,依据在守恒配平书写;
②将已知方程式换算成目标方程式,焓变进行相应的改变,结合盖斯定律计算得到;
(2)①阴极上得电子发生还原反应;
②阴极上加入的物质应该具有还原性,反应后的生成物没有污染;
(3)A、根据反应物和生成物的能量变化确定焓变;
B、根据温度判断,在不同温度区域,TiI4的量是否发生改变;
C、温度不同,反应方程式不同,产物不同
D、在提纯过程中,根据反应确定I2的量是否变化.
②将已知方程式换算成目标方程式,焓变进行相应的改变,结合盖斯定律计算得到;
(2)①阴极上得电子发生还原反应;
②阴极上加入的物质应该具有还原性,反应后的生成物没有污染;
(3)A、根据反应物和生成物的能量变化确定焓变;
B、根据温度判断,在不同温度区域,TiI4的量是否发生改变;
C、温度不同,反应方程式不同,产物不同
D、在提纯过程中,根据反应确定I2的量是否变化.
解答:
解:(1)沸腾炉中流程可知反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,
反应的化学方程式为:TiO2+2C+2Cl2=TiCl4+2CO;
故答案为:TiO2+2C+2Cl2=TiCl4+2CO;
②(I) Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;
(II) 2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;
(III) Na(s)=Na(l)△H=ckJ/mol,
将方程式2(II)-(I)-4(III)得TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),△H=2b-4c-a;
故答案为:2b-4c-a;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连;电极反应式为TiO2+4e-=Ti+2O2-,阴极上加入的物质应该具有还原性且是气体,反应后的生成物没有污染,水没有污染,所以该气体是氢气,
故答案为:负;TiO2+4e-=Ti+2O2-;H2;
(3)A、大多数混合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的△H<0,故A错误;
B、高于400℃,钛和氯气反应生成四氯化钛,在1250℃四氯化钛分解,所以在不同温度区域,TiI4的量不同,故B错误;
C、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的作用是将粗钛从低温区转移到高温区,故C正确;
D、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的量不变,可以循环利用,故D正确;
故选CD.
反应的化学方程式为:TiO2+2C+2Cl2=TiCl4+2CO;
故答案为:TiO2+2C+2Cl2=TiCl4+2CO;
②(I) Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;
(II) 2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;
(III) Na(s)=Na(l)△H=ckJ/mol,
将方程式2(II)-(I)-4(III)得TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),△H=2b-4c-a;
故答案为:2b-4c-a;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连;电极反应式为TiO2+4e-=Ti+2O2-,阴极上加入的物质应该具有还原性且是气体,反应后的生成物没有污染,水没有污染,所以该气体是氢气,
故答案为:负;TiO2+4e-=Ti+2O2-;H2;
(3)A、大多数混合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的△H<0,故A错误;
B、高于400℃,钛和氯气反应生成四氯化钛,在1250℃四氯化钛分解,所以在不同温度区域,TiI4的量不同,故B错误;
C、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的作用是将粗钛从低温区转移到高温区,故C正确;
D、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的量不变,可以循环利用,故D正确;
故选CD.
点评:本题考查了金属的冶炼、电极反应式的书写、热化学反应等知识点,注意焓变的有关计算、电极反应式的书写是高考的热点,应重点掌握.

练习册系列答案
相关题目
下列物质在空气中不能稳定存在的是( )
| A、Fe(OH)2 |
| B、Fe(OH)3 |
| C、K3Fe(CN)6 |
| D、Cu(NH3)4SO4 |
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为( )
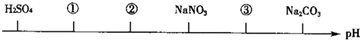
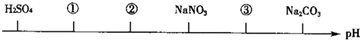
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )| A、此有机物含有如下的官能团:含有碳碳双键、羟基、羰基、羧基 |
| B、1mol该有机物与NaOH 溶液反应,耗2mol.与氢气反应耗氢气5mol |
| C、该有机分子中没有一个有手性碳 |
| D、该有机物不存在顺反异构 |

 图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )
图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )