题目内容
12.某温度下,将H2(g)和I2(g)各1mol的气态混合物充入2L的密闭容器中,充分反应,5min后达到平衡,测得c(HI)=0.2mol/L.(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率.
(2)求该反应的平衡常数.
(3)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2mol,求达到平衡时I2(g)的物质的量浓度.
分析 5min后达到平衡,测得c(HI)=0.2mol/L,则
H2(g)+I2(g)?2HI(g)
起始 0.5 0.5 0
转化 0.1 0.1 0.2
平衡 0.4 0.4 0.2
(1)结合v=$\frac{△c}{△t}$计算;
(2)K为生成物浓度幂之积与反应物浓度之积的比;
(3)温度不变,则K不变,设转化的I2(g)为xmol/L,则
H2(g)+I2(g)?2HI(g)
起始 1 1 0
转化 x x 2x
平衡 1-x 1-x 2x
$\frac{(2x)^{2}}{(1-x)(1-x)}$=K,以此来解答.
解答 解:5min后达到平衡,测得c(HI)=0.2mol/L,则
H2(g)+I2(g)?2HI(g)
起始 0.5 0.5 0
转化 0.1 0.1 0.2
平衡 0.4 0.4 0.2
(1)从反应开始至达到平衡,用H2(g)表示的反应速率为$\frac{0.1mol/L}{5min}$=0.02mol/(L.min),
答:从反应开始至达到平衡,用H2(g)表示的反应速率为0.02mol/(L.min);
(2)该反应的平衡常数K=$\frac{0.{2}^{2}}{0.4×0.4}$=0.25,
答:该反应的平衡常数为0.25;
(3)温度不变,则K不变,设转化的I2(g)为xmol/L,则
H2(g)+I2(g)?2HI(g)
起始 1 1 0
转化 x x 2x
平衡 1-x 1-x 2x
$\frac{(2x)^{2}}{(1-x)(1-x)}$=K=0.25,解得x=0.2,
则平衡时c(I2)═0.8 mol/L,
答:达到平衡时I2(g)的物质的量浓度为0.8mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法,K及速率的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.

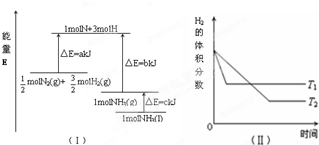
| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
①
 ②
② ③CH3OH④
③CH3OH④
⑤
 ⑥
⑥
| A. | ①④⑤ | B. | ④ | C. | ②⑥ | D. | ①②⑥ |
| A. | 0.044mol/L | B. | 0.44mol/L | C. | 4.4mol/L | D. | 44mol/L |
| A. | 该反应达到平衡状态时c(CO2)=c(CO) | |
| B. | 该反应的正反应是放热反应 | |
| C. | 若起始时把Fe和2.0mol CO2放入体积固定为1 L的密闭容器中,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=1.0 | |
| D. | 若该反应在体积固定的密闭容器中进行,在恒温下达到平衡状态,再通入CO反应混合气体中CO2的物质的量分数增大 |
| A. | 1mol的氢氧根离子中的电子数目约为9NA | |
| B. | 56 g铁片投入足量稀H2SO4中生成NA个SO2分子 | |
| C. | 标准状况下,11.2 L NH3中含有分子的数目为0.5NA | |
| D. | 在铜与足量稀硝酸的反应中,每生成0.1 mol气体,转移电子的数目为0.2NA |