题目内容
1.(1)O2和O3是氧元素的两种单质,质量之和为96克的O2和O3的气体混合,其氧原子个数为1:1.(2)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为5.4mL.
(3)现要配制1mol•L-1 Na2CO3溶液250mL,求:
①需要含结晶水的碳酸钠晶体(Na2CO3•10H2O)71.5g;
②在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有:ACE
A.固体Na2CO3•10 H2O放在右盘(1 g以下用游码)
B.容量瓶用碳酸钠溶液先润洗
C.转移溶液时未洗涤烧杯
D.定容时,溶液未冷却;
E.定容时视线仰视;
F.摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G.容量瓶未干燥.
分析 (1)假设O2和O3的质量均为48g,根据n=$\frac{m}{M}$计算各自物质的量,结合分子组成计算O原子数;
(2)先计算浓硫酸的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算所需浓盐酸的体积;
(3)①所需碳酸钠的物质的量n=CV=1mol/L×0.25L=0.25mol,由于1mol碳酸钠晶体(Na2CO3•10H2O)能提供1molNa2CO3,故所需Na2CO3•10H2O的物质的量也为0.25mol,质量m=nM,据此求算;
②根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析,凡是不当操作使n偏小或者使V偏大的操作都会使溶液浓度偏低,凡是不当操作使n偏大或者使V偏小的操作都会使溶液浓度偏高,据此解答.
解答 解:(1)假设O2和O3的质量均为48g,
则O2的物质的量为$\frac{48g}{32g/mol}$=1.5mol,
O3的物质的量为$\frac{48g}{48g/mol}$=1mol,
故O2和O3所含分子个数比为1.5mol:1mol=3:2;
O2和O3均由O原子构成,则氧原子质量相等,含有O原子数目相等,即原子个数比为1:1;
故答案为:1:1;
(2)浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V,根据溶液稀释前后溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,V=0.0054L=5.4mL,
故答案为:5.4;
(3)①配制1mol•L-1 Na2CO3溶液250mL,所需碳酸钠的物质的量n=CV=1mol/L×0.25L=0.25mol,由于1mol碳酸钠晶体(Na2CO3•10H2O)能提供1molNa2CO3,故所需Na2CO3•10H2O的物质的量也为0.25mol,质量m=nM=0.25mol×286g/mol=71.5g;
故答案为:71.5g;
②A.固体Na2CO3•10 H2O放在右盘,则称量时,药品的实际质量偏小,所以配制的溶液的浓度偏小,故A选;
B.容量瓶用碳酸钠溶液先润洗,容量瓶中碳酸钠的物质的量偏大,所以配制的溶液的浓度偏大,故B不选;
C.转移溶液时未洗涤烧杯,烧杯中有残留的碳酸钠,则容量瓶中碳酸钠的物质的量偏小,所以配制的溶液的浓度偏小,故C选;
D.定容时,溶液未冷却,冷却后溶液的体积减小,所以配制的溶液的浓度偏大,故D不选;
E.定容时视线仰视,溶液的体积偏大,则配制的溶液的浓度偏小,故E选;
F.摇匀时,发现液面低于容量瓶刻度线,但未补加水,溶液的浓度不变,故F不选;
G.容量瓶未干燥,对溶液的体积无影响,溶液的浓度不变,故G不选;
故选ACE.
点评 本题考查了物质的量的计算、一定物质的量浓度溶液的配制过程中的计算和误差分析,准确判断不当操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 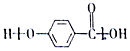 的结构中含有酯基 的结构中含有酯基 | |
| B. | 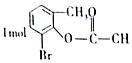 一定条件下与足量NaOH溶液反应,最多消耗3molNaOH 一定条件下与足量NaOH溶液反应,最多消耗3molNaOH | |
| C. | 按系统命名法,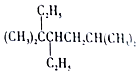 的名称为3,3,6-三甲基-4-乙基庚烷 的名称为3,3,6-三甲基-4-乙基庚烷 | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
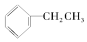 ⑤CH3COOCH3 ⑥
⑤CH3COOCH3 ⑥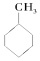
| A. | ②③⑤ | B. | ①⑤⑥ | C. | ①④⑥ | D. | ①④⑤ |
| A. | Fe+Cl2 (过量)→ | B. | Fe+浓盐酸(过量)→ | C. | FeBr2(过量)+Cl2→ | D. | FeCl3+Fe(少量)→ |
| A. | 升高温度,活化分子百分数增大,正、逆反应速率都加快 | |
| B. | 使用催化剂,活化分子百分数增大,正、逆反应速率都加快 | |
| C. | 使用催化剂可以降低反应的活化能 | |
| D. | 升高温度,上述反应的平衡常数会增大 |
| A. | 铜和硝酸反应 | B. | 二氧化碳通入氢氧化钠溶液中 | ||
| C. | 细铁丝在氯气中燃烧 | D. | 铁和与硫酸溶液反应 |
| A. | I-、Br-、CrO4- | B. | Br-、Cl-、CrO4- | C. | CrO4-、Br-、I- | D. | Br-、CrO4-、Cl- |
| A. | 常温常压下,8gCH4中含有的氢原子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 常温常压下,48氧气和臭氧(O3)混合物中所含氧原子总数为3NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为1NA |