题目内容
2.常温下,下列各组微粒在指定溶液中一定能大量共存的是( )| A. | 甲基橙呈红色的溶液中:S2O32-、Al3+、C2O42-、SO42- | |
| B. | Kw/c(H+ )=0.1mol•L-1的溶液:K+、Na+、CO32-、NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 无色溶液中:Cr2O72-、NH4+、Cl-、S2- |
分析 A.甲基橙呈红色的溶液,显酸性;
B.Kw/c(H+ )=0.1mol•L-1的溶液,显碱性;
C.离子之间结合生成沉淀;
D.Cr2O72-为橙色,且Cr2O72-、S2-发生氧化还原反应.
解答 解:A.甲基橙呈红色的溶液,显酸性,不大量存在S2O32-、C2O42-,故A错误;
B.Kw/c(H+ )=0.1mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.Ag+分别与SO42-、I-结合生成沉淀,不能共存,故C错误;
D.Cr2O72-为橙色,与无色不符,且Cr2O72-、S2-发生氧化还原反应,不能共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
13.下列说法正确的是( )
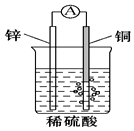

| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| C. | 右图原电池中,电池工作时,SO42-移向电池的正极 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
14.某溶液中可能含有Na+、I-、K+、Fe 2+、NH4+、Cu2+、SO32-、SO42-且所有 离子物质的量浓度相等.向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 肯定不含SO42- |
10.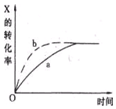 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 减压 | B. | 加大X的投入量 | C. | 升高温度 | D. | 减小体积 |
17.X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物与其最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3:4.下列说法中正确的是( )
| A. | 原子半径:W>Z>Y>X | B. | 氢化物稳定性:Y>Z | ||
| C. | WY3中只有离子键没有共价键 | D. | YX3可用于检验Cl2泄漏 |
7. (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.
(二)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图.
(2)请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(3)若已知下列数据:
试根据表中及图中数据计算N-H的键能390kJ•mol-1
(4)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1变化是:E1减小 (填“增大”、“减小、”“不变”).
(5)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H1=akJ•mol-1
N2(g)+O2(g)?2NO(g)△H2=b kJ•mol-1
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
 (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.(二)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图.
(2)请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(3)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(4)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1变化是:E1减小 (填“增大”、“减小、”“不变”).
(5)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H1=akJ•mol-1
N2(g)+O2(g)?2NO(g)△H2=b kJ•mol-1
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
14.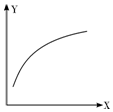 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 减小压强 | A的转化率 |
| D | 升高温度 | 混合气体平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
11.在密闭容器中发生下列反应 aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向正反应方向移动 | ||
| C. | D的物质的量变多 | D. | a>c+d |
12.下列化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | 乙烯的电子式: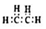 | |
| C. | 硫离子结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |