题目内容
19.短周期主族元素X、Y、Z、W的原子序数依次增大.X是地壳中含量最高的元素,Y+与X2-具有相同的电子层结构,Y与Z位于相邻主族,W与X同主族.下列说法正确的是( )| A. | W的氢化物比X的氢化物稳定 | |
| B. | Y在周期表中的位置为第3周期、IB族 | |
| C. | Z的最高价氧化物对应的水化物的碱性比Y的弱 | |
| D. | X的单质与含W化合物不可能发生置换反应 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.X是地壳中含量最高的元素,则X为O;Y+与X2-具有相同的电子层结构,则Y为Na,Y与Z位于相邻主族,Z为Mg,W与X同主族,W为S,以此来解答.
解答 解:由上述分析可知,X为O,Y为Na,Z为Mg,W为S,
A.非金属性O>S,则X的氢化物比W的氢化物稳定,故A错误;
B.Y为Na,在周期表中的位置为第3周期、IA族,故B错误;
C.金属性Na>Mg,则Z的最高价氧化物对应的水化物的碱性比Y的弱,故C正确;
D.X的单质与含W化合物可发生置换反应,如氧气与硫化物反应生成S和水,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 盐酸 | D. | CuSO4溶液 |
10.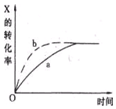 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 减压 | B. | 加大X的投入量 | C. | 升高温度 | D. | 减小体积 |
7. (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.
(二)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图.
(2)请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(3)若已知下列数据:
试根据表中及图中数据计算N-H的键能390kJ•mol-1
(4)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1变化是:E1减小 (填“增大”、“减小、”“不变”).
(5)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H1=akJ•mol-1
N2(g)+O2(g)?2NO(g)△H2=b kJ•mol-1
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
 (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.(二)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图.
(2)请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(3)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(4)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1变化是:E1减小 (填“增大”、“减小、”“不变”).
(5)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H1=akJ•mol-1
N2(g)+O2(g)?2NO(g)△H2=b kJ•mol-1
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
14.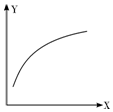 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 减小压强 | A的转化率 |
| D | 升高温度 | 混合气体平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
4. 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
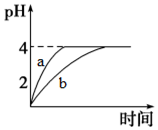
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1<m2(选填“<”、“=”或“>”).
(2)25℃时,向水的电离平衡体系中加入适量碳酸钠固体,其水解方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,测得溶液的pH=12,则由水电离出的c(OH-)=0.01mol•L-1.
(3)生活中常用用醋酸除去水垢(主要成分CaCO3),请从平衡角度解释原因:碳酸钙存在沉淀溶解平衡,CaCO3(s)?Ca2+(aq)+CO32-(aq),醋酸为弱酸存在电离平衡,CH3COOH?CH3COO-+H+,氢离子结合碳酸根离子促进程度溶解平衡正向进行,碳酸钙溶解.
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
①在常温下,相同物质的量浓度的a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液三种溶液的pH由小到大的顺序为c<a<b(用序号回答).
②向NaCN溶液中通入少量的CO2,发生反应的离子方程式为CO2+H2O+CN-=HCO3-+HCN.
③25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1<m2(选填“<”、“=”或“>”).
(2)25℃时,向水的电离平衡体系中加入适量碳酸钠固体,其水解方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,测得溶液的pH=12,则由水电离出的c(OH-)=0.01mol•L-1.
(3)生活中常用用醋酸除去水垢(主要成分CaCO3),请从平衡角度解释原因:碳酸钙存在沉淀溶解平衡,CaCO3(s)?Ca2+(aq)+CO32-(aq),醋酸为弱酸存在电离平衡,CH3COOH?CH3COO-+H+,氢离子结合碳酸根离子促进程度溶解平衡正向进行,碳酸钙溶解.
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的离子方程式为CO2+H2O+CN-=HCO3-+HCN.
③25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
11.在密闭容器中发生下列反应 aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向正反应方向移动 | ||
| C. | D的物质的量变多 | D. | a>c+d |
8.甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO32-+6H2O.则下列说法正确的是( )
| A. | 电池放电时通入空气的电极为负极 | |
| B. | 由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大 | |
| C. | 电池放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 电池放电时每消耗1 mol CH3OH转移8 mol电子 |
9.下列有关物质性质的说法正确的是( )
| A. | 乙醇在铜催化加热下可制得乙醚 | |
| B. | 淀粉在稀硫酸催化加热下可制得氨基酸 | |
| C. | 苯和乙烯在一定条件下反应可制得乙苯 | |
| D. | 乙苯与酸性高锰酸钾溶液反应生成苯乙酸 |