题目内容
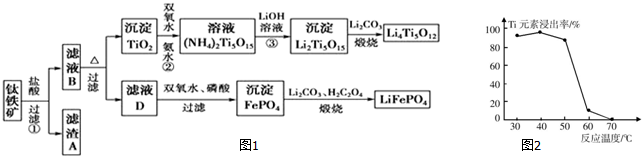
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: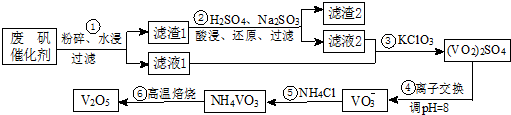
部分含钒物质在水中的溶解性见表.回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)滤渣1中含矾的物质被Na2SO3还原的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
请配平滤液2中VOSO4被KClO3氧化的化学方程式:6VOSO4+KClO3+3H2O═3(VO2)2SO4
+KCl+3H2SO4.
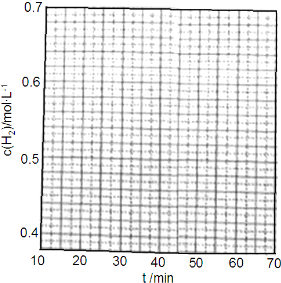
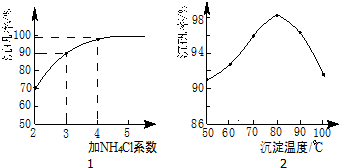
(3)步骤⑤沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中
V2O5的质量比)和温度.根据图判断沉矾最佳控制氯化铵系数和温度分别为4、80℃;从平
衡移动角度解释沉矾过程中控制n(NH4+):n(VO3-)>1:1,原因是增大铵根离子浓度,可以提高VO3-转化率,以保证VO3-沉淀完全.
(4)步骤⑥反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:
VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+;
若用放电的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用效率为$\frac{965}{384}$m×100%(写出表达式,不必计算出结果.已知:电量Q=It,t为时间秒;电解时Q=znF,$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$
z为每摩尔物质得失电子数、法拉第常数F=96500C/mol,).
分析 废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液1中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液2,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件书写方程式;
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4;VOSO4被KClO3氧化的反应中矾从+4价变为+3价,氯元素从+5价变为-1价,根据电子得失守恒及元素守恒书写化学方程式;
(3)根据图知,在80℃、氯化铵系数为4时沉降率最大;根据平衡移动原理,增大铵根离子浓度,可以提高VO3-转化率;
(4)步骤⑥反应为NH4VO3受热分解生成V2O5和NH3,据此答题;
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极上VO2+失电子发生氧化反应,电解精炼铜得到铜mg时,电解消耗的电量Q=znF,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量,根据$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$,可计算出电流利用率.
解答 解:(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,反应的化学方程式为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,
故答案为:3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4,反应的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O,VOSO4被KClO3氧化的反应中矾从+4价变为+3价,氯元素从+5价变为-1价,根据电子得失守恒及元素守恒可知,反应的化学方程式为6VOSO4+KClO3+3H2O═3(VO2)2SO4+KCl+3H2SO4 ,
故答案为:V2O5+SO32-+4H+═2VO2++SO42-+2H2O;6;3H2O;
(3)根据图知,在80℃、氯化铵系数为4时沉降率最大;根据平衡移动原理,增大铵根离子浓度,可以提高VO3-转化率,
故答案为:4;80℃;增大铵根离子浓度,可以提高VO3-转化率;
(4)步骤⑥反应为NH4VO3受热分解生成V2O5和NH3,反应的方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O,
故答案为:2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O;
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极上VO2+失电子发生氧化反应,电极反应式为VO2++H2O-e-=VO2++2H+,电解精炼铜得到铜mg时,即铜的物质的量为$\frac{m}{64}$mol,所以电解消耗的电量Q=2×$\frac{m}{64}$mol×96500C/mol=,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,所以$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$=$\frac{\frac{96500m}{32}C}{1200As}$×100%=$\frac{965}{384}$m×100%,
故答案为:VO2++H2O-e-=VO2++2H+;$\frac{965}{384}$m×100%.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查氧化还原反应、离子反应方程式的书写、原电池和电解池原理等知识点,明确反应原理是解本题关键,知道流程图中发生的反应及实验基本操作,难点是电流利用率的计算,题目难度中等.

| A. | 二氯化氧(OCl2) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 六氟化氙(XeF6) |
| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
| A. | 0.2 mol | B. | 0.5 mol | C. | 2 mol | D. | 5 mol |