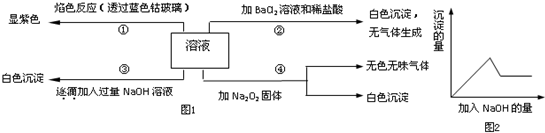
题目内容
15.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、CaO、SiO2等杂质.利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如图1所示: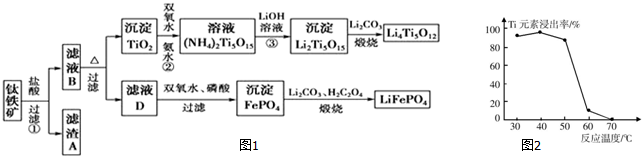
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-═Fe2++TiOCl42-+2H2O.1
(1)化合物FeTiO3中铁元素的化合价是+2.
(2)滤渣A的成分是SiO2.
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式为TiOCl42-+H2O=TiO2↓+2H++4Cl-.
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示.反应温度过高时,Ti元素浸出率下降的原因是温度过高时,反应物氨水(或双氧水)受热易分解.
(5)写出由滤液D生成FePO4的离子方程式2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+.
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是20:9.
分析 铁矿石加入盐酸溶解过滤得到滤渣A为二氧化硅,滤液B中含有MgCl2、CaCl2、FeCl2、TiCl2等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4.
(1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
(2)MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
(4)二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
(5)过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁;
(6)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比.
解答 解:铁矿石加入盐酸溶解过滤得到滤渣A为二氧化硅,滤液B中含有MgCl2、CaCl2、FeCl2、TiCl2等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4.
(1)反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,
故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,
故答案为:SiO2;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5)过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,反应离子方程式为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+,
故答案为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+;
(6)根据电子守恒,过氧化氢氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,因此可得关系式:H2O2~H2C2O4,
设双氧水质量为x,草酸质量为y,则:
H2O2~H2C2O4
34 90
x×17% y
所以34y=90×x×17%,整理可得x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:20:9.
点评 本题以钛铁矿制备锂离子电池电极材料工艺流程为载体,考查陌生方程式书写、元素化合物性质、对条件控制的分析评价、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.

| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:SiO2>NaCl>CH4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.(1)该滴定实验所需的玻璃仪器有ADE.
A.酸式滴定管(50mL) B.碱式滴定管(50mL)
C.量筒(50mL) D.锥形瓶 E.烧杯
(2)不用碱(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液.试分析原因酸性KMnO4溶液会腐蚀碱式滴定管下端胶管.
(3)滴定终点的现象为当滴入最后一滴标准液时,溶液从无色变成紫红色,且半分钟内保持不变色.
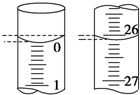
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL.
(5)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 2 8.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数.

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率(只要求写出一种)
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为Al2O3+3C+3Cl2$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO.
(3)气体Ⅱ的主要成分除了Cl2外,还含有CO2、O2、SiCl4.气体Ⅱ常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有CO32-、HCO3-、Cl-、ClO-、SiO32-、OH-.
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是NaCl、FeCl2.
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为4Al2Cl7-+3e-=7AlCl4-+Al.
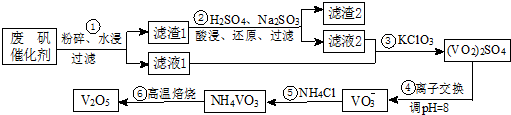
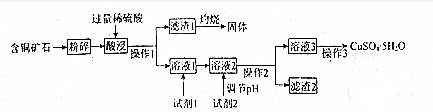
部分含钒物质在水中的溶解性见表.回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)滤渣1中含矾的物质被Na2SO3还原的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
请配平滤液2中VOSO4被KClO3氧化的化学方程式:6VOSO4+KClO3+3H2O═3(VO2)2SO4
+KCl+3H2SO4.
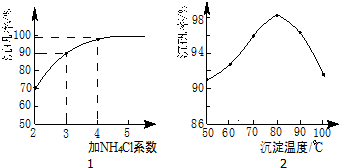
(3)步骤⑤沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中
V2O5的质量比)和温度.根据图判断沉矾最佳控制氯化铵系数和温度分别为4、80℃;从平
衡移动角度解释沉矾过程中控制n(NH4+):n(VO3-)>1:1,原因是增大铵根离子浓度,可以提高VO3-转化率,以保证VO3-沉淀完全.
(4)步骤⑥反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:
VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+;
若用放电的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用效率为$\frac{965}{384}$m×100%(写出表达式,不必计算出结果.已知:电量Q=It,t为时间秒;电解时Q=znF,$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$
z为每摩尔物质得失电子数、法拉第常数F=96500C/mol,).
已知:ⅰ.试剂价格:漂液(含25.2%NaClO)450元/吨,双氧水(含30%H2O2)2400元/吨.
ⅱ.溶液中离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
ⅲ.25℃时,金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表所示,
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
(1)含铜矿石粉碎的目的为增大矿石与稀硫酸的接触面积,加快酸浸速率并使酸浸更充分,滤渣Ⅰ灼烧所得固体的用途为制备光导纤维、制备玻璃、生产硅单质等(任写一种).
(2)操作Ⅰ所用的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)试剂1的名称为漂液,选择该试剂的理由为节约成本,所发生反应的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O.
(4)加入试剂2,需调节溶液的pH的合理范围为3.7≤PH<4.0,试剂2可以选择下列物质中的BC(填选项字母).
A.Cu B.CuO C.Cu(OH)2 D.Fe
(5)操作3包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥、洗涤的方法为用玻璃棒引流向过滤器中加入冷水至浸没沉淀,待水自然流下,重复2-3次.
(6)25℃时,Cu(OH)2 的溶度积常数K溶[Cu(OH)2]=1.0×10-20.
| A. | 原子 | B. | 分子 | C. | 核素 | D. | 元素 |