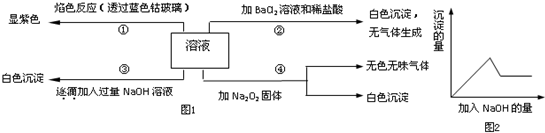
题目内容
3.下列分子中所有原子都满足最外层8电子稳定结构的是( )| A. | 二氯化氧(OCl2) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 六氟化氙(XeF6) |
分析 在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答.
解答 解:A.二氯化氧(OCl2)中,O元素位于第VIA族,则6+2=8,Cl元素位于第VIIA族,则7+1=8,满足分子中所有原子都满足最外层8电子结构,故A选;
B.HClO中,H元素一定不满足8电子结构,故B不选;
C.BF3中,B元素位于第ⅢA族,则3+3≠8,则不满足分子中所有原子都满足最外层8电子结构,故C不选;
D.六氟化氙(XeF6),Xe原子的原子核外最外层电子数为8,其在分子中的化合价为+6价,在分子中的原子最外层电子数为14,Xe元素一定不满足8电子结构,故D不选;
故选A.
点评 本题考查原子核外电子数,明确元素的位置、最外层电子数、成键数即可判断,注意规律的应用来解答,题目难度不大.

练习册系列答案
相关题目
11.下列判断错误的是( )
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:SiO2>NaCl>CH4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
18.元素的性质呈现周期性变化的根本原因是( )
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol溴苯中含有双键的数目为0.3NA | |
| B. | 1L 0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA | |
| C. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA |
15.在密闭容器中进行的可逆反应2X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别0.1mol•L-1、0.2mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能( )
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
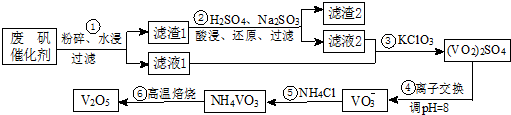
部分含钒物质在水中的溶解性见表.回答下列问题:
(1)工业上用铝热剂法由V2O5冶炼金属钒的化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤渣1中含矾的物质被Na2SO3还原的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
请配平滤液2中VOSO4被KClO3氧化的化学方程式:6VOSO4+KClO3+3H2O═3(VO2)2SO4
+KCl+3H2SO4.
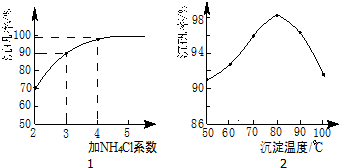
(3)步骤⑤沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中
V2O5的质量比)和温度.根据图判断沉矾最佳控制氯化铵系数和温度分别为4、80℃;从平
衡移动角度解释沉矾过程中控制n(NH4+):n(VO3-)>1:1,原因是增大铵根离子浓度,可以提高VO3-转化率,以保证VO3-沉淀完全.
(4)步骤⑥反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:
VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+;
若用放电的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用效率为$\frac{965}{384}$m×100%(写出表达式,不必计算出结果.已知:电量Q=It,t为时间秒;电解时Q=znF,$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$
z为每摩尔物质得失电子数、法拉第常数F=96500C/mol,).

部分含钒物质在水中的溶解性见表.回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)滤渣1中含矾的物质被Na2SO3还原的离子方程式为V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
请配平滤液2中VOSO4被KClO3氧化的化学方程式:6VOSO4+KClO3+3H2O═3(VO2)2SO4
+KCl+3H2SO4.
(3)步骤⑤沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中
V2O5的质量比)和温度.根据图判断沉矾最佳控制氯化铵系数和温度分别为4、80℃;从平
衡移动角度解释沉矾过程中控制n(NH4+):n(VO3-)>1:1,原因是增大铵根离子浓度,可以提高VO3-转化率,以保证VO3-沉淀完全.
(4)步骤⑥反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.

(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:
VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+;
若用放电的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用效率为$\frac{965}{384}$m×100%(写出表达式,不必计算出结果.已知:电量Q=It,t为时间秒;电解时Q=znF,$电流利用效率=\frac{负载利用电量}{电池输出电量}×100%$
z为每摩尔物质得失电子数、法拉第常数F=96500C/mol,).
 .
.