题目内容
2.按要求完成下列空白:(1)同位素主要决定于质子数和中子数
(2)质量数决定于质子数和中子数;
(3)原子序数决定于质子数;
(4)元素的化学性质主要决定于最外层电子数.
分析 (1)有相同质子数,不同中子数的原子互为同位素;
(2)质量数等于质子数与中子数之和;
(3)元素在周期表中原子序数=质子数;
(4)元素的化学性质与元素核外电子排布有关,主要主要决定于最外层电子数.
解答 解:(1)同位素是质子数相同,而中子数不同的原子,同位素主要决定于质子数和中子数,
故答案为:质子数和中子数;
(2)果忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,所得的数值叫做质量数,因此,在原子中,质量数等于质子数与中子数之和,即质量数决定于质子数和中子数,
故答案为:质子数和中子数;
(3)按照元素在周期表中的顺序给元素编号,就得到原子序数,而元素在周期表中是按照质子数排列的,即质子数=原子序数,故原子序数决定于质子数,
故答案为:质子数;
(4)在原子结构中,最外层电子数目决定了元素的主要化学性质,如最外层电子数小于4的容易失电子,大于4的容易得电子,
故答案为:最外层电子数.
点评 本题考查有关同位素、质量数、原子序数、元素的化学性质的决定因素,掌握相关概念是解答关键,题目难度不大.

练习册系列答案
相关题目
10.某元素的一种同位素原子${\;}_{Z}^{A}$X,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
17.下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.其中J为0族元素.
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为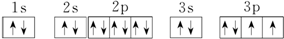 .
.
(2)在化合物YZ2中Y的化合价为+2;Y2-与Na+的半径大小为O2->Na+.
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是F>O>N;X与Y的第一电离能:X>Y(填“<”、“>”或“=”),其理由是N原子的p轨道为半充满,能量低较稳定,难失电子.
| X | Y | Z | |
| R | |||
| W | |||
| J |
(1)R原子的电子排布图为
 .
.(2)在化合物YZ2中Y的化合价为+2;Y2-与Na+的半径大小为O2->Na+.
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是F>O>N;X与Y的第一电离能:X>Y(填“<”、“>”或“=”),其理由是N原子的p轨道为半充满,能量低较稳定,难失电子.
11.(1)除去甲烷中的乙烯气体可用溴水(填试剂名称).实验方法为洗气(填操作名称).
(2)下列有关蒸馏乙醇和提纯苯甲酸实验的判断不正确的有b;
a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶
b.如果温度计水银球位置低于支管口下沿,则收集的乙醇含有低沸点杂质
c.提纯苯甲酸时,用热水溶解,冷却后过滤除去固体杂质
d.测定苯甲酸晶体的熔点可能判断苯甲酸晶体是否为纯净物
(3)两种有机物A和B可以互溶,有关性质如下:
若要除去A和B的混合物中少量的B,可采用b(填代号)方法即可得到A.
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液.
(2)下列有关蒸馏乙醇和提纯苯甲酸实验的判断不正确的有b;
a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶
b.如果温度计水银球位置低于支管口下沿,则收集的乙醇含有低沸点杂质
c.提纯苯甲酸时,用热水溶解,冷却后过滤除去固体杂质
d.测定苯甲酸晶体的熔点可能判断苯甲酸晶体是否为纯净物
(3)两种有机物A和B可以互溶,有关性质如下:
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液.
12.某元素最高价氧化物对应水化物的分子式是H2RO4,则其氢化物的分子式是( )
| A. | RH4 | B. | RH3 | C. | H2R | D. | HR |
 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题. .
.