题目内容
7.海水中溴含量约为65mg•L-1,从海水中提取溴的工业流程如下: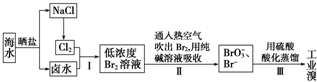
(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集(或浓缩)溴元素.
(2)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO${\;}_{3}^{2-}$═□BrO${\;}_{3}^{-}$+□Br-+□CO2↑
当生成标准状况下22.4L CO2时,该反应转移电子数为$\frac{5}{3}$NA或$\frac{5}{3}$×6.02×1023.
(3)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的离子方程式:Br2+SO2+2H2O═4H++SO42-+2Br-.
(4)实验室分离溴还可以用有机溶剂萃取法,萃取后如果要得到纯溴应如何操作:蒸馏.
(5)氧化剂氯气来自电解饱和食盐水,电解槽使用了隔膜(或离子交换膜)来防止氯气与氢氧化钠溶液反应.
①电解时,阳极反应式为2Cl--2e-═Cl2↑.
②若采用无隔膜的电解槽,将得到H2和NaClO.
分析 海水晒盐得到氯化钠和卤水,电解氯化钠溶液或电解熔融氯化钠得到氯气,氯气通入卤水氧化溴离子为溴单质,得到低浓度的溴单质的溶液,通入热空气吹出溴蒸气,用纯碱溶液吸收后的溶液中加入硫酸酸化得到溴单质,起到富集溴的作用,最后得到工业溴.
(1)步骤Ⅰ中已获得游离态的溴的含量较低;
(2)根据反应物、生成物,结合转移电子守恒、原子守恒配平方程式;结合化合价的变化计算电子的转移数目;
(3)溴与二氧化硫水溶液反应,生成硫酸和HBr;
(4)一般用苯或四氯化碳萃取溴,可用蒸馏的方法分离;
(5)电解饱和食盐水,阳极生成氯气,阴极生成氢气和氢氧化钠,若采用无隔膜的电解槽,氯气又和氢氧化钠反应生成次氯酸钠和氯化钠.
解答 解:海水晒盐得到氯化钠和卤水,电解氯化钠溶液或电解熔融氯化钠得到氯气,氯气通入卤水氧化溴离子为溴单质,得到低浓度的溴单质的溶液,通入热空气吹出溴蒸气,用纯碱溶液吸收后的溶液中加入硫酸酸化得到溴单质,起到富集溴的作用,最后得到工业溴.
(1)步骤Ⅰ中已获得游离态的溴的含量较低,步骤Ⅱ又将之转化为化合态的溴,其目的是富集溴,故答案为:富集(或浓缩)溴元素;
(2)该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为:3Br2+3CO32-═BrO3-+5Br-+3CO2↑,反应中Br元素化合价分别由0价变化为+5价、-1价,当生成标准状况下22.4L CO2时,则有1mol溴参加反应,生成$\frac{5}{3}$molBr-,转移$\frac{5}{3}$mol电子,数目为$\frac{5}{3}$NA或$\frac{5}{3}$×6.02×1023,
故答案为:3;3;1;5;3;$\frac{5}{3}$NA或$\frac{5}{3}$×6.02×1023;
(3)溴与二氧化硫水溶液反应,生成硫酸和HBr,离子反应为Br2+SO2+2H2O═4H++SO42-+2Br-,故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;
(4)一般用苯或四氯化碳萃取溴,因混合物的沸点不同,则可用蒸馏的方法分离,故答案为:蒸馏;
(5)①电解饱和食盐水,阳极生成氯气,电极方程式为2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑;
②若采用无隔膜的电解槽,氯气又和氢氧化钠反应生成次氯酸钠和氯化钠,故答案为:NaClO.
点评 本题考查混合物分离提纯的综合应用及海水提溴,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. |  属于醇类 属于醇类 | B. |  属于羧酸 属于羧酸 | C. |  属于酮类 属于酮类 | D. |  属于酚类 属于酚类 |
| A. | 反应中生成(2g+h)molH2O | B. | 2d+3f=3g+h | ||
| C. | 2<3g+h<3 | D. | h随着d增大而增大 |
①NH3的熔、沸点比第ⅤA族相邻元素的氢化物高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥NH3分子加热难分解.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 正戊烷的熔沸点比异戊烷的高 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
①金属钠②溴水③碳酸钠溶液④紫色石蕊试液.
| A. | ①②③④均可 | B. | 只有①②④ | C. | 只有②③④ | D. | 只有③④ |

