题目内容
11.(1)除去甲烷中的乙烯气体可用溴水(填试剂名称).实验方法为洗气(填操作名称).(2)下列有关蒸馏乙醇和提纯苯甲酸实验的判断不正确的有b;
a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶
b.如果温度计水银球位置低于支管口下沿,则收集的乙醇含有低沸点杂质
c.提纯苯甲酸时,用热水溶解,冷却后过滤除去固体杂质
d.测定苯甲酸晶体的熔点可能判断苯甲酸晶体是否为纯净物
(3)两种有机物A和B可以互溶,有关性质如下:
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液.
分析 (1)乙烯和溴发生加成反应,甲烷和乙烯不反应,所以可以用溴水除去甲烷中的乙烯;
(2)a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶,根据仪器的用途选取仪器;
b.蒸馏烧瓶中温度从下到上逐渐降低;
c.温度高时,苯甲酸的溶解度小;
d.纯净物有固定的熔点;
(3)互溶且沸点相差较大的液体可以采用蒸馏方法分离提纯.
解答 解:(1)乙烯和溴发生加成反应,甲烷和乙烯不反应,所以可以用溴水除去甲烷中的乙烯,实验方法为洗气,
故答案为:溴水;洗气;
(2)a.蒸馏乙醇的主要仪器有蒸馏烧瓶、温度计、冷凝管、铁架台、酒精灯、接液管和锥形瓶,蒸馏烧瓶盛放液体、温度计测定温度、冷凝管冷凝蒸气、接液管接收液体、锥形瓶盛放蒸馏得到的液体,故正确;
b.蒸馏烧瓶中温度从下到上逐渐降低,所以如果温度计水银球位置低于支管口下沿,则收集的乙醇含有沸点杂质
,故错误;
c.温度高时,苯甲酸的溶解度小,所以提纯苯甲酸时,用热水溶解,冷却后过滤除去固体杂质,从而得到较纯净的苯甲酸,故正确;
d.纯净物有固定的熔点,如果苯甲酸不纯,则测定的熔点与苯甲酸熔点有差异,故正确;
故选b;
(3)根据表中数据知,A和B的沸点相差较大,可以采用蒸馏方法分离,故选b.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、物质分离和提纯、仪器的选取等知识点,明确实验原理、物质性质差异性、实验基本操作方法是解本题关键,侧重考查学生实验操作、实验设计、实验评价能力,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
19.下列现象与氢键有关的是( )
①NH3的熔、沸点比第ⅤA族相邻元素的氢化物高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥NH3分子加热难分解.
①NH3的熔、沸点比第ⅤA族相邻元素的氢化物高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥NH3分子加热难分解.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
16.关于烷烃的叙述不正确的是( )
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 正戊烷的熔沸点比异戊烷的高 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
3.下列关于钠的说法中,不正确的是( )
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 钠原子的最外层只有一个电子 | |
| C. | 钠的化学性质很活泼,少量的钠可以保存在煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
1.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的中子数是8.
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式: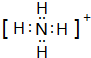 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| R | 原子半径最小的元素 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式:
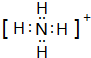 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.