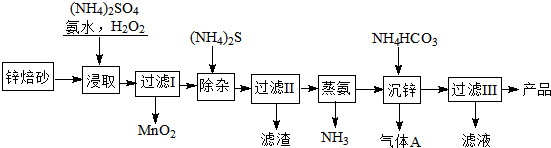
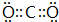题目内容
14. 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.Ⅰ.氢气可以由自然界中大量存在的水来制取:2H2O(l)═2H2(g)+O2(g)该反应要吸收大量的热
回答下列问题:
(1)关于用水制取二级能源氢气,以下研究方向不正确的是AC
A.构成水的氢和氧都是可以燃烧的物质,因此可研究水不分解的情况下,使氢气成为二级能源.
B.设法将太阳光聚集,产生高温,使水分解产生氢气.
C.寻找高效催化剂,使水分解产生氢气,同时释放能量.
D.寻找特殊催化剂,用于开发廉价能量,以分解水制取氢气.
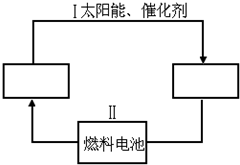
(2)氢能源既是绿色能源,又可循环使用.请在如图两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图.
从能量转换的角度看,过程Ⅱ主要是化学能转化为电能.
Ⅱ.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况).甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L.据此判断
(1)甲的化学式是AlH3;乙的电子式是
 .
.(2)甲与水反应的化学方程式是AlH3+3H2O=Al(OH)3+3H2↑.该反应中每生成1molH2,转移电子的数目为NA.
(3)甲与乙之间可能(填“可能”或“不可能)发生反应产生H2,判断理由是AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气.
分析 Ⅰ.(1)A、水不分解也就是物质不变化,物质不变化也就不会产生新物质,不产生新物质就没有氢气.
B.通过水分解产生氢气,这是可行的.
C.水分解产生氢气,但需要吸收能量.
D.开发廉价能源,以分解水制氢气,可节约能源;
(2)分析转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气;
Ⅱ.白色沉淀可溶于NaOH溶液,应为Al(OH)3,说明甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g•L-1,则丙的相对原子质量为1.25g•L-1×22.4L=28,应为N2,则乙为NH3,结合对应的物质以及题目要求可解答该题.
解答 解:Ⅰ.(1)A.氢气、氧气是两种单质,氢气具有可燃性,可成为新能源,氧气不可以燃烧,只有助燃性.水是由氢元素和氧元素组成.元素不等同于单质.所以,构成水的氢和氧都是可以燃烧的物质,说法错误.水在不分解的情况下,不会产生新物质,不产生新物质,就没有氧气和氢气,水就不会成为新能源.因此可研究在水不分解的情况下,使氢成为二级能源,故A错误;
B.太阳能是一种廉价能源.水在高温下可以分解,设法将太阳光聚焦,产生高温,使水分解产生氢气和氧气.氢气具有可燃性,可作为新能源,故B正确;
C.使用催化剂,可以加快化学反应速率,但水的分解是吸热反应,故C错误;
D.水可以分解生成H2,氢气具有可燃性,燃烧放热.但分解水需高温条件,需消耗能量,寻找特殊的化学物质,可无需在高温条件下分解水,降低成本,用于开发廉价能源,故D正确,
故答案为:AC;
(2)转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气,过程Ⅱ是发生的原电池反应,能量变化是化学能转化为电能的过程;
故答案为:化学;电;
Ⅱ.白色沉淀可溶于NaOH溶液,应为Al(OH)3,说明甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g•L-1,则丙的相对原子质量为1.25g•L-1×22.4L=28,应为N2,则乙为NH3,
(1)由以上分析可知甲为AlH3,乙为NH3,电子式为

(2)AlH3与水发生氧化还原反应,反应的方程式为AlH3+3H2O=Al(OH)3↓+3H2↑,反应中H元素化合价分别由-1价、+1价变化为0价,则该反应中每生成1molH2,转移电子的数目为NA,
故答案为:AlH3+3H2O=Al(OH)3+3H2↑;NA;
(3)AlH3中的H为-1价,NH3中的H为+1价,从化合价的角度可知二者可能发生氧化还原反应生成氢气,
故答案为:可能;AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气.
点评 本题考查较为综合,涉及能源的转化以及无机物的推断,侧重于学生的分析、计算能力的考查,题目难度不大,注意根据先关反应的现象以及数据判断甲乙两种物质,注意相关反应的化学方程式的书写.

| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.0010mol/(L•s) | ||
| C. | v(NO)=0.0010mol/(L•s) | D. | v(H2O)=0.045mol/(L•s) |
①NH3的熔、沸点比第ⅤA族相邻元素的氢化物高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥NH3分子加热难分解.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 钠原子的最外层只有一个电子 | |
| C. | 钠的化学性质很活泼,少量的钠可以保存在煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴的四氯化碳溶液褪色,又能使酸性高锰酸钾溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 1mol该烃能与4molBr2发生加成反应 |