题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA |
| B、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C、0.25molNa2O2中含有的阴离子数为0.5NA |
| D、18gD2O(重水)完全电解,转移的电子数为NA |
考点:阿伏加德罗常数
专题:
分析:A、氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯元素化合价0价变化为+1和-1价;
B、pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度=
=0.1mol/L,计算氢氧根离子数;
C、过氧化钠是由钠离子和过氧根离子构成分析;
D、依据n=
计算物质的量,结合反应的化学方程式计算电子转移.
B、pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度=
| 10-14 |
| 10-13 |
C、过氧化钠是由钠离子和过氧根离子构成分析;
D、依据n=
| m |
| M |
解答:
解:A、氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯元素化合价0价变化为+1和-1价,0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA,故A正确;
B、pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度=
=0.1mol/L,计算氢氧根离子数=0.1mol/L×1L×NA=0.1NA,故B错误;
C、过氧化钠是由钠离子和过氧根离子构成分析,0.25molNa2O2中含有的阴离子数为0.25NA,故C错误;
D、依据n=
计算物质的量=
=0.9mol,结合反应的化学方程式计算电子转移,2D2O=2D2↑+O2↑,0.9mol重水反应电子转移1.8NA,故D错误;
故选A.
B、pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度=
| 10-14 |
| 10-13 |
C、过氧化钠是由钠离子和过氧根离子构成分析,0.25molNa2O2中含有的阴离子数为0.25NA,故C错误;
D、依据n=
| m |
| M |
| 18g |
| 20g/mol |
故选A.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算,物质结构理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
| A、Fe2(SO4)3 |
| B、Na2CO3 |
| C、KNO3 |
| D、FeSO4 |
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某试剂一段时间后,发现铜粉质量减少,溶液呈蓝色.加入试剂:①FeCl2;②Na2CO3;③KNO3;④FeSO4;⑤FeCl3;⑥H2O2;⑦NaClO;⑧NaOH.则该试剂可能是( )
| A、①④⑤ | B、②③⑦⑧ |
| C、③⑤⑥⑦ | D、全部 |
将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是( )
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |
 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下: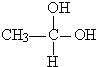 →CH3-CHO+H2O
→CH3-CHO+H2O