题目内容
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
| A、Fe2(SO4)3 |
| B、Na2CO3 |
| C、KNO3 |
| D、FeSO4 |
考点:铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:Cu与稀硫酸不反应,硝酸盐在酸性条件下具有硝酸的强氧化性,则可使Cu溶解,由发生的氧化还原反应可知生成的气体,以此来解答.
解答:
解:A.Cu、稀硫酸、硫酸铁混合时,铜和硫酸铁发生氧化还原反应,生成硫酸亚铁和硫酸铜,造成铜粉的质量减少,但没有气体,故A错误;
B.Cu与稀硫酸不反应,加入Na2CO3时与酸反应生成二氧化碳气体,但Cu不溶解,故B错误;
C.Cu、稀硫酸、KNO3混合时发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,则铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,故C正确;
D.Cu、稀硫酸、FeSO4混合时不反应,故D错误.
故选C.
B.Cu与稀硫酸不反应,加入Na2CO3时与酸反应生成二氧化碳气体,但Cu不溶解,故B错误;
C.Cu、稀硫酸、KNO3混合时发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,则铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,故C正确;
D.Cu、稀硫酸、FeSO4混合时不反应,故D错误.
故选C.
点评:本题考查硝酸盐在酸性条件下的性质,明确选项中各物质的性质及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法错误的是( )
| A、若a=b=3,8>m>n>b,则元素非金属性:X>Y |
| B、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |
| C、若Y的气态氢化物化学式为YHn,且b<4,则该氢化物易溶于水 |
| D、若a<b=3,m=n=7,已知原子半径大小:Y>N(氮原子)>X,则NX3、NY3与水反应生成不同的含氮化合物 |
将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,铜片质量增加的是( )
| A、硝酸 |
| B、稀盐酸 |
| C、Ca(OH)2溶液 |
| D、乙醇 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA |
| B、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C、0.25molNa2O2中含有的阴离子数为0.5NA |
| D、18gD2O(重水)完全电解,转移的电子数为NA |
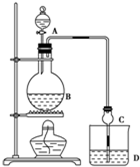 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.