题目内容
将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是( )
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |
考点:离子浓度大小的比较
专题:
分析:n(醋酸)=0.001L×0.5mol/L=5×10-4mol,n(NaOH)=0.002L×0.25mol/L=5×10-4mol,二者的物质的量相等,二者混合时恰好反应生成CH3COONa,CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,即c (OH-)>c(H+),再结合电荷守恒判断c(Na+)、c(CH3COO-)相对大小.
解答:
解:n(醋酸)=0.001L×0.5mol/L=5×10-4mol,n(NaOH)=0.002L×0.25mol/L=5×10-4mol,二者的物质的量相等,二者混合时恰好反应生成CH3COONa,CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,即c (OH-)>c(H+),再结合电荷守恒得c(Na+)>c(CH3COO-),铵根离子水解但程度较小,所以c(CH3COO-)>c (OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c (OH-)>c(H+),故选A.
点评:本题考查离子浓度大小比较,明确溶质的特点确定溶液酸碱性,再结合电荷守恒解答,注意盐类水解程度都较小,所以强酸弱碱盐或强碱弱酸盐溶液的酸性或碱性都较小,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA |
| B、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C、0.25molNa2O2中含有的阴离子数为0.5NA |
| D、18gD2O(重水)完全电解,转移的电子数为NA |
已知HCN的电离常数Ka=5×10-10,H2CO3离常数Ka1=4.3×10-7、Ka2=5.6×10-11,判断在等浓度的NaCN、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A、c(HCO3-)>c(CN- )>c(OH- ) |
| B、c(CN- )>c(HCO3-)>c(H+ ) |
| C、c(HCN)+c(CN- )=c(HCO3-)+c(H2CO3) |
| D、c(Na+ )+c(H+ )=c(HCO3- )+c(CN- )+C(OH- ) |
已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:aFe2++bBr-+cCl2═dFe3++eBr2+fCl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A、2 6 4 2 3 8 |
| B、2 4 3 2 2 6 |
| C、2 0 1 2 0 2 |
| D、2 2 2 2 1 4 |
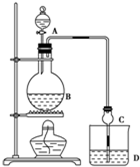 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.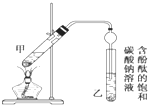 某学生在实验室制取乙酸乙酯的主要步骤如下:
某学生在实验室制取乙酸乙酯的主要步骤如下: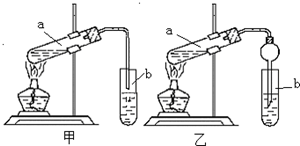 某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:
某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题: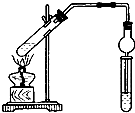 用如图所示实验装置制取乙酸乙酯.回答以下问题:
用如图所示实验装置制取乙酸乙酯.回答以下问题: 出发来合成A,其合成路线如图:
出发来合成A,其合成路线如图: