题目内容
12. 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为Anm(填标号).
A.404.4B.553.5 C.589.2D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是N,占据该能层电子的电子云轮廓图形状为球形.K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是K的原子半径较大,且价电子较少,金属键较弱.
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子.I3+离子的几何构型为V形,中心原子的杂化类型为sp3.
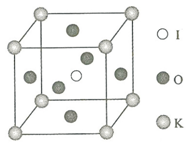
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为0.315nm,与K紧邻的O个数为12.
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于体心位置,O处于棱心位置.
分析 (1)紫色波长介于400nm~435nm之间;
(2)基态K原子核外有4个电子层,最高能层为第四层,最外层电子为4s1电子,K和Cr属于同一周期,K的原子半径较大,且价电子较少,金属键较弱;
(3)I3+中心原子的价层电子对数为$\frac{7+1×2-1}{2}$=4,则为sp3杂化,价层电子对为正四面体,中心I原子的孤电子对数为$\frac{7-1×2-1}{2}$=2,为V形;
(4)K与O间的最短距离为面对角线的一半;O位于面心,K位于顶点,1个顶点为12个面共有;
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×$\frac{1}{8}$=1,则K也为1,应位于体心,则O位于棱心,个数为12×$\frac{1}{4}$=3.
解答 解:(1)紫色波长介于400nm~435nm之间,只有A符合,故答案为:A;
(2)基态K原子核外有4个电子层,最高能层为第四层,即N层,最外层电子为4s1电子,该能层电子的电子云轮廓图形状为球形,K和Cr属于同一周期,K的原子半径较大,且价电子较少,金属键较弱,则金属K的熔点、沸点等都比金属Cr低,
故答案为:N;球形;K的原子半径较大,且价电子较少,金属键较弱;
(3)I3+中心原子的价层电子对数为$\frac{7+1×2-1}{2}$=4,则为sp3杂化,价层电子对为正四面体,中心I原子的孤电子对数为$\frac{7-1×2-1}{2}$=2,为V形,故答案为:V形;sp3;
(4)K与O间的最短距离为面对角线的一半,则K与O间的最短距离为$\frac{\sqrt{2}}{2}$×0.446nm=0.315nm,O位于面心,K位于顶点,1个顶点为12个面共有,即与K紧邻的O个数为12个,
故答案为:0.315;12;
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×$\frac{1}{8}$=1,则K也为1个,应位于体心,则O位于棱心,每个棱为4个晶胞共有,则O个数为12×$\frac{1}{4}$=3,故答案为:体心;棱心.
点评 本题为2017年考题,题目涉及核外电子排布、杂化、晶胞的计算等知识,综合考查学生的分析能力和计算能力,题目易错点为(3),注意价层电子对的判断,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 将铜丝插入浓硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 将过氧化钠投入足量水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42-+2Ba2++2OH-═Fe(OH)2↓+2BaSO4↓ |
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
| A. | Fe$→_{点燃}^{Cl_{2}}$FeCl2$\stackrel{NaOH(ap)}{→}$Fe(OH)2 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | CaCO3$\stackrel{高温}{→}$CaO$→_{高温}^{SiO_{2}}$CaSiO3 | |
| D. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 邻甲基苯甲酸( 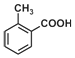 )含有苯环且属于酯类的同分异构体有5种 )含有苯环且属于酯类的同分异构体有5种 | |
| B. | CH3-CH=CH-CH2-CH3中最多有9个原子在同一平面上 | |
| C. | 有机物 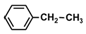 在一定条件下与足量H2加成,所得产物的一氯代物有5种 在一定条件下与足量H2加成,所得产物的一氯代物有5种 | |
| D. | 可以用裂化汽油萃取溴水中的溴 |
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.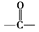 和
和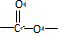 .
.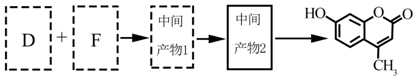

 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.