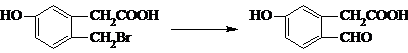
题目内容
0.5molNa2Cr2O2中含有Na的数目是 .
考点:物质的量的相关计算
专题:
分析:结合N=nNA及物质的构成来计算.
解答:
解:0.5mol Na2Cr2O2中,Na+的物质的量为0.5mol×2=1mol,由N=nNA可知,其个数为6.02×1023个,
故答案为:6.02×1023.
故答案为:6.02×1023.
点评:本题考查物质的量的计算,为高频考点,把握物质的量与微粒个数的关系及物质构成为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
已知AgCl、AgBr的溶解度分别为1.5×10-4g、8.4×10-6 g(20℃).将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )
| A、只有AgBr沉淀生成 |
| B、AgCl和AgBr沉淀等量生成 |
| C、AgCl沉淀少于AgBr沉淀 |
| D、AgCl沉淀多于AgBr沉淀 |
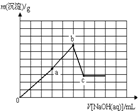
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )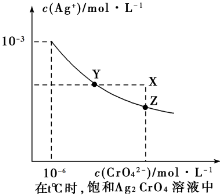

| A、在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B、在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C、在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/LKCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
| D、在t℃时,反应Ag2CrO4(s)+2 Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
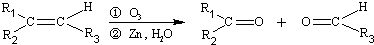 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
 :
:
 属芳香醚,其同系物的通式为:
属芳香醚,其同系物的通式为: