题目内容
10.41克纯铁丝溶于过量的盐酸中,在加热条件下,用5.05克的KNO3去氧化溶液中的Fe2+,待反应完后,剩余Fe2+还需要24mL0.3mol/L的KMnO4溶液才能完全氧化成Fe3+,此时KMnO4转化为Mn2+,则KNO3的还原产物为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
考点:氧化还原反应的计算
专题:
分析:铁丝溶于过量的盐酸中得到的是亚铁离子,再加入硝酸钾,硝酸会将亚铁离子氧化为铁离子,硝酸被还原,根据和硝酸参加反应的亚铁离子的量以及硝酸的量结合电子守恒计算硝酸钾的还原产物.
解答:
解:10.41克纯铁丝的物质的量:
≈0.186mol,所以得到亚铁离子的物质的量是0.186mol,5.05克的KNO3的物质的量是:
=0.05mol,即硝酸是0.05mol,剩余Fe2+被KMnO4溶液才能完全氧化成Fe3+的反应为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,则
MnO4-~5Fe2+
1 5
0.024L×0.3mol/L
被硝酸氧化后,剩余的亚铁离子是5×0.024L×0.3mol/L=0.036mol,被硝酸氧化的亚铁链子物质的量是:0.186mol-0.036mol=0.15mol,根据电子守恒,设硝酸被还原产物中N的化合价是x,则0.15mol(3-2)=0.05mol(5-x),解得x=2,所以KNO3的还原产物为NO.
故选B.
| 10.41g |
| 56g/mol |
| 5.05g |
| 101g/mol |
MnO4-~5Fe2+
1 5
0.024L×0.3mol/L
被硝酸氧化后,剩余的亚铁离子是5×0.024L×0.3mol/L=0.036mol,被硝酸氧化的亚铁链子物质的量是:0.186mol-0.036mol=0.15mol,根据电子守恒,设硝酸被还原产物中N的化合价是x,则0.15mol(3-2)=0.05mol(5-x),解得x=2,所以KNO3的还原产物为NO.
故选B.
点评:本题考查了氧化还原反应中电子守恒的计算知识,掌握物质性质和离子反应的电子转移是解题关键,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
核糖是合成核酸的重要原料,其结构简式为:CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述中,正确的是( )
| A、与葡萄糖互为同分异构体 |
| B、可以与银氨溶液作用形成银镜 |
| C、与葡萄糖互为同系物 |
| D、可以使石蕊试液变红 |
 如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A、浓H2SO4 |
| B、饱和NaCl溶液 |
| C、浓NaOH溶液 |
| D、饱和Na2CO3 |
密闭容器中有如下反应:mA(g)+nB(g)?pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.8倍.下列说法中正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率降低 |
| C、平衡向正反应方向移动 |
| D、C的质量分数增加 |
温度为T时,向4.0L恒容密闭容器中充入2.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A、反应在前50 s的平均速率为v(PCl3)=0.0064 mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入4.0molPCl3、4.0molCl2,达到平衡时,PCl3的转化率等于80% |
| D、相同温度下,起始时向容器中充入2.0molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |
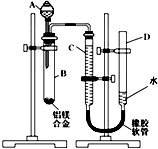 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.