题目内容
由锌和铜构成的合金共 36g,放入足量的稀盐酸中充分反应,产生标准状况下气体4.48L,试求合金中铜的质量分数.
考点:有关混合物反应的计算
专题:
分析:Cu、Zn合金中只有Zn与盐酸反应生成氢气,而Cu不反应,根据电子转移守恒计算n(Zn),再根据m=nM计算Zn的质量,进而计算Cu的质量,再计算Cu的质量分数.
解答:
解:Cu、Zn合金与足量盐酸反应生成氢气4.48L,其物质的量为
=0.2mol,
Cu、Zn合金中只有Zn与盐酸反应生成氢气,而Cu不反应,根据电子转移守恒n(Zn)=
=0.2mol,故m(Zn)=0.2mol×65g/mol=13g,则m(Cu)=36g-13g=23g,
故Cu、Zn合金中Cu的质量分数为
×100%=63.89%,
答:合金中铜的质量分数为63.89%.
| 4.48L |
| 22.4L/mol |
Cu、Zn合金中只有Zn与盐酸反应生成氢气,而Cu不反应,根据电子转移守恒n(Zn)=
| 0.2mol×2 |
| 2 |
故Cu、Zn合金中Cu的质量分数为
| 23g |
| 36g |
答:合金中铜的质量分数为63.89%.
点评:本题考查混合物计算,比较基础,明确发生的反应是关键,侧重对基础知识的巩固.

练习册系列答案
相关题目
Na2O和Na2O2的下列叙述中正确的是( )
| A、Na2O比Na2O2稳定 |
| B、均可与CO2、H2O反应产生氧气 |
| C、Na2O是淡黄色固体,而Na2O2是白色固体 |
| D、阴阳离子个数比均为1:2 |
温度为T时,向4.0L恒容密闭容器中充入2.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A、反应在前50 s的平均速率为v(PCl3)=0.0064 mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入4.0molPCl3、4.0molCl2,达到平衡时,PCl3的转化率等于80% |
| D、相同温度下,起始时向容器中充入2.0molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |
 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中都通入xmolA和ymolB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中都通入xmolA和ymolB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A、若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B、若x:y=1:2,则平衡时,M中的转化率:A>B |
| C、若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D、若x=1.2,y=1,N中达到平衡时体积为2 L,含有0.4mol C,再通入0.36 mol A时,v(逆)>v(正) |
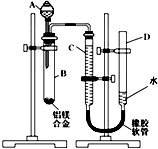 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.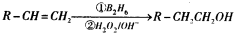
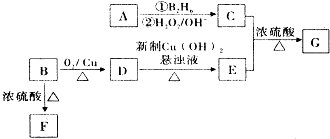
 ”基团.
”基团.