题目内容
1.(1)20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.(2)3.01×1023个H2O的物质的量为0.5mol,其中所有的原子的物质的量为1.5mol,所有的电子的物质的量为5mol.
(3)将标准状况下22.4LHCl气体溶于水配成500ml溶液,所得溶液的物质的量浓度是2mol/L,从其中取出100ml该溶液,则这100ml该溶液的物质的量浓度为2mol/L,这100ml该溶液所含溶质的质量为7.3
(4)将钠、镁、铝各0.4mol分别放入100mL 1mol/L的盐酸中,同温同压下产生的气体体积比为4:1:1.
分析 (1)氯离子的浓度为氯化钡浓度的2倍;根据n=cV计算出钡离子的物质的量;
(2)根据n=$\frac{N}{{N}_{A}}$计算出3.01×1023个H2O的物质的量;根据水的组成计算出含有的原子的物质的量;水分子中含有10个电子,据此计算出水分子中含有电子的物质的量;
(3)根据n=$\frac{V}{{V}_{m}}$计算出HCl的物质的量,再根据c=$\frac{n}{V}$计算出所得溶液的浓度;溶液具有均一性,则取出溶液的浓度不变;根据n=cV计算出100mL溶液中含有HCl的物质的量,再根据m=nM计算出含有HCl的质量;
(4)钠和稀盐酸、水都反应,根据Na计算生成氢气物质的量;Mg、Al不与水反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.4molMg、Al完全反应需要盐酸的物质的量分别是0.8mol、1.2mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,根据HCl生成氢气物质的量,相同条件下气体体积之比等于物质的量之比.
解答 解:(1)20mL 0.1mol/LBaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(BaCl2)=0.1mol/L×2=0.2mol/L;
Ba2+的物质的量浓度为0.1mol/L,该溶液中含有钡离子的物质的量为:0.1mo/L×0.02L=0.002mol,
故答案为:0.2mol/L;20.002mol;
(2)3.01×1023个H2O的物质的量为:$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$mol=0.5,0.5mol水分子中含有的原子的物质的量为:0.5mol×(2+1)=1.5mol;0.5mol水分子中含有的电子的物质的量为:0.5mol×10=5mol,
故答案为:0.5;1.5;5;
(3)将标准状况下22.4LHCl气体溶于水配成500mL溶液,含有HCl的物质的量为:n(HCl)=$\frac{22.4L}{22.4L/mol}$=1mol,所得溶液的物质的量浓度为:c=$\frac{1mol}{0.5L}$=2mol/L;
从其中取出100mL该溶液,溶液具有均一性,则这100mL该溶液的物质的量浓度仍然为2mol/L;这100ml该溶液所含溶质的物质的量为:2mol/L×0.1L=0.2mol,该溶液中含有HCl的质量为:36.5g/mol×0.2mol=7.3g,
故答案为:2mol/L;2mol/L;7.3g;
(4)钠和稀盐酸、水都反应,根据2Na~H2↑可知,0.4molNa完全反应,生成氢气的物质的量=0.4mol×$\frac{1}{2}$=0.2mol,
Mg、Al不与水反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.4molMg、Al完全反应需要盐酸的物质的量分别是0.8mol、1.2mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,所以二者与酸反应生成氢气的量相等,由氢原子守恒,可知生成氢气的量为:$\frac{0.1mol}{2}$=0.05mol,所以同温同压下产生的气体的物质的量之比=0.2mol:0.05mol:0.05mol=4:1:1,
故答案为:4:1:1.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度、气体摩尔体积等之间的关系为解答关键,试题计算量较大,充分考查了学生的化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案( )
| A. | 烷烃最少 | B. | 烯烃最少 | C. | 炔烃最少 | D. | 三者一样多 |
| A. | 晶体中的化学键都具有饱和性和方向性 | |
| B. | 晶体中只要有阴离子,就一定有阳离子 | |
| C. | 石墨是一种典型的原子晶体 | |
| D. | 冰中存在极性共价键和氢键两种化学键 |
| A. | Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| B. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| A. | 原子半径Z>W>Y>X | |
| B. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| C. | 气态氢化物的稳定性Z>W | |
| D. | X与Y的最高正化合价之和的数值等于10 |
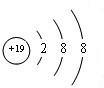 ,C原子的结构示意图为
,C原子的结构示意图为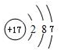 .
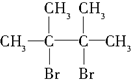
.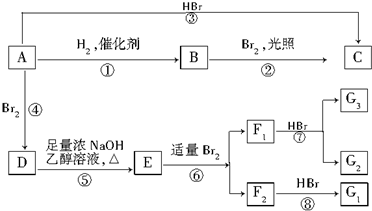
 )(F1和F2互为同分异构体)(G1和G2互为同分异构体)
)(F1和F2互为同分异构体)(G1和G2互为同分异构体) .
. .
.