题目内容
16.A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1mol C能与2mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同;D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B或E生成CO2的量相同.(1)试确定A、B、C、D、E的结构简式:
A:CH≡CH;B:CH2=CH2;C:CH2=CH-CH=CH2;D:CH4;E:CH3CH3.
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是甲烷(填名称,下同),生成二氧化碳最多的是乙炔.
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是1,3-丁二烯(填名称,下同),生成水最多的是1,3-丁二烯和乙烷.
分析 A、B、C、D、E为五种气态烃,D是最简单的有机物,则D为CH4;1molC与2molBr2完全加成,生成物分子中每个碳原子都有一个溴原子,则C含有4个C原子,为1,3-丁二烯与溴发生加成反应;A与C通式相同,A与H2加成可得到B,B与N2密度相同,则B的相对分子质量为28,故B为CH2=CH2、A为CH≡CH;E为D的同系物,属于烷烃,完全燃烧等摩尔B、E,生成CO2相同,则E分子中含有2个C原子,故E为CH3CH3,据此分析解答.
解答 解:A、B、C、D、E为五种气态烃,D是最简单的有机物,则D为CH4;1molC与2molBr2完全加成,生成物分子中每个碳原子都有一个溴原子,则C含有4个C原子,为1,3-丁二烯与溴发生加成反应;A与C通式相同,A与H2加成可得到B,B与N2密度相同,则B的相对分子质量为28,故B为CH2=CH2、A为CH≡CH;E为D的同系物,属于烷烃,完全燃烧等摩尔B、E,生成CO2相同,则E分子中含有2个C原子,故E为CH3CH3,
(1)通过以上分析知,A、B、C、D、E的结构简式分别为CH≡CH、CH2=CH2、CH2=CH-CH=CH2、CH4、CH3CH3,
故答案为:CH≡CH;CH2=CH2;CH2=CH-CH=CH2;CH4;CH3CH3;
(2)等质量的烃(CxHy)完全燃烧时耗氧量取决于$\frac{y}{x}$,该比值越大耗氧量越多,该比值最大的是甲烷,则耗氧量最多的是甲烷;该比值越大,生成的二氧化碳越少,该比值最小的是乙炔,所以生成二氧化碳最多的是乙炔,故答案为:甲烷;乙炔;
(3)等物质的量的烃完全燃烧耗氧量取决于x+$\frac{y}{4}$的值,该值越大耗氧量越多,所以耗氧量最多的是1,3-丁二烯,生成水的物质的量取决于H原子个数,氢原子越多,生成的水越多,所以生成水最多的是1,3-丁二烯和乙烷,
故答案为:1,3-丁二烯;1,3-丁二烯和乙烷.
点评 本题考查有机物推断及有关计算,为高频考点,侧重考查学生分析推断及计算能力,明确各个物理量之间的关系是解本题关键,题目难度中等.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | CH3CH2CH3 | B. | CH3-O-CH3 | C. |  | D. |  |
Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间;
Ⅱ.分子的空间构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;ⅲ.X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;ⅳ.其他.请仔细阅读上述材料,回答下列问题:
(1)根据要点Ⅰ可以画出AXnEm的VSEPR理想模型,请填写下表:
| n+m | 2 | |
| VSEPR理想模型 | 正四面体形 | |
| 价层电子对 之间的理想键角 | 109°28′ |
(3)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型:
| 分子 | |||
| 或离子 | SnCl2 | CCl4 | ClO${\;}_{4}^{-}$ |
| 立体构型 |
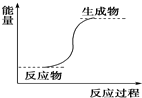
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | NaOH与HCl的反应 | D. | 甲烷与O2的燃烧反应 |

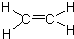 ,C的名称为乙醛
,C的名称为乙醛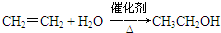 ;反应类型是加成反应;
;反应类型是加成反应;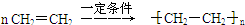 ;反应类型是加聚反应.
;反应类型是加聚反应. 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.