题目内容
6.关于晶体的下列说法正确的是( )| A. | 晶体中的化学键都具有饱和性和方向性 | |
| B. | 晶体中只要有阴离子,就一定有阳离子 | |
| C. | 石墨是一种典型的原子晶体 | |
| D. | 冰中存在极性共价键和氢键两种化学键 |
分析 A.离子键没有饱和性和方向性;
B.金属晶体中不含阴离子,有阴离子的必须含阳离子;
C.石墨为混合晶体;
D.氢键不是化学键.
解答 解:A.离子键没有饱和性和方向性,共价键具有饱和性和方向性,故A错误;
B.金属晶体中不含阴离子,由金属阳离子和自由电子构成,但有阴离子一定存在阳离子,故B正确;
C.石墨为混合晶体,层与层之间存在分子间作用力,故C错误;
D.氢键不是化学键,冰中只含共价键这种化学键,故D错误;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关金属晶体的说法中正确的是( )
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 金属晶体都是体心立方堆积 | D. | 都能导电、传热 |
11.现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于VA族的有:④⑦(用编号表示)
(2)处于第2周期的元素有:①③⑦⑧被称为“矾”的一类化合物中肯定含有表中①(以上均用编号表示)
(3)写出②、⑤的元素符号:Mg、Cl.
(4)上述元素中金属性最强的是:Na(用元素符号表示)
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于VA族的有:④⑦(用编号表示)
(2)处于第2周期的元素有:①③⑦⑧被称为“矾”的一类化合物中肯定含有表中①(以上均用编号表示)
(3)写出②、⑤的元素符号:Mg、Cl.
(4)上述元素中金属性最强的是:Na(用元素符号表示)
14.铝土矿是工业炼铝的主要原料,某铝土矿样品组成如下:
主要成分:Al2O3杂质:Fe2O3、SiO2及其他不溶且不参与化学反应的物质为测定该样品中Al的含量,某化学兴趣小组设计了如下两个方案:
【查阅资料】各相关离子开始沉淀和沉淀完全时溶液的pH如表:
方案一:将铝土矿加足量盐酸溶解,再调节pH,使Fe3+沉淀完全而Al3+不沉淀.需调节pH范围应是3.2~3.4,若想得到氯化铝固体需将其溶液通入HCl气流中直至蒸干.
方案二:

(1)②反应的离子方程式为OH-+CO2=CO32-+H2O,2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓.CO2不可过量的原因是防止SiO32-被沉淀.
(2)若在步骤②中加入乙酸乙酯调节pH,加热也可得到d的沉淀,写出生成d沉淀的化学方程式AlO2-+CH3COOCH2CH3+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+Al(OH)3↓+CH3CH2OH.
主要成分:Al2O3杂质:Fe2O3、SiO2及其他不溶且不参与化学反应的物质为测定该样品中Al的含量,某化学兴趣小组设计了如下两个方案:
【查阅资料】各相关离子开始沉淀和沉淀完全时溶液的pH如表:
| Al3+ | Fe3+ | AlO2- | SiO32- | |
| 开始沉淀时 | 3.4 | 1.9 | 10.6 | 7.3 |
| 沉淀完全时 | 4.7 | 3.2 | 9.3 | 5.3 |
方案二:

(1)②反应的离子方程式为OH-+CO2=CO32-+H2O,2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓.CO2不可过量的原因是防止SiO32-被沉淀.
(2)若在步骤②中加入乙酸乙酯调节pH,加热也可得到d的沉淀,写出生成d沉淀的化学方程式AlO2-+CH3COOCH2CH3+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+Al(OH)3↓+CH3CH2OH.
11.将等体积的SO2和Cl2气混和后通入含有石蕊的水中,溶液的颜色将( )
| A. | 褪色 | B. | 仍为紫色 | C. | 变红 | D. | 变蓝 |
18.下列各组中,互称为同素异形体的是( )
| A. | O2与O3 | B. | 35Cl与37Cl | C. |  | D. | CH4与C2H6 |
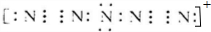 .
.