题目内容
10.一种熔融碳酸盐燃料电池原理示意如图.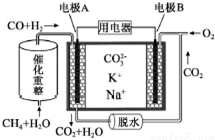
下列有关该电池的说法不正确的是( )
| A. | 电极A上H2参与的电极反应为:CO+H2+2CO32--4e-=3CO2+H2O | |
| B. | 理论上,A极每消耗1molH2,则消耗$\frac{1}{3}$molCH4 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
分析 原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,根据电子守恒结合反应方程式解答该题.
解答 解:A.原电池工作时,CO和H2失电子在负极反应,A为负极,负极上CO和H2失电子发生了氧化反应,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,故A正确;
B.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,
根据反应CH4+H2O=3H2+CO,理论上,A极每消耗1molH2,转移4mol电子,则消耗$\frac{2}{3}$molCH4,故B错误;
C.电池工作时,CO32-向负极即向着电极A移动,故C正确;
D.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故D正确.
故选B.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
相关题目
20.井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发生的反应:FeS2+H2O═Q+S+H2S↑ (已配平),则物质Q是( )
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)2 | D. | Fe(OH)3 |
18.下列关于氯水的说法中,不正确的是( )
| A. | 氯水是指氯气的水溶液 | |
| B. | 在pH试纸上滴新制氯水,试纸会先变红后褪色 | |
| C. | 久置的氯水漂白作用更强 | |
| D. | 新制氯水应避光保存 |
5.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将2mol SO2和1mol O2在相同条件下反应生成SO3,放出的热量为Q1,则( )
| A. | Q1=Q | B. | Q1>Q | C. | Q1<Q | D. | 无法判断 |
19.当温度不变时,恒容的容器中进行反应2A?B,若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20秒,那么由0.06mol•L-1降到0.036mol•L-1,所需反应的时间为( )
| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
20.下列说法正确的是( )
| A. | 32 g 18O2中含有的氧原子数是2×6.02×1023 | |
| B. | 1 mol N2和CO的混合气体中含有的分子总数是2×6.02×1023 | |
| C. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023 | |
| D. | 1.0 L 0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |
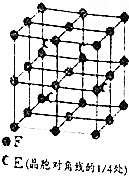 A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.
A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2. .
.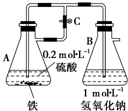 当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
 .
.