题目内容
18.下列关于氯水的说法中,不正确的是( )| A. | 氯水是指氯气的水溶液 | |
| B. | 在pH试纸上滴新制氯水,试纸会先变红后褪色 | |
| C. | 久置的氯水漂白作用更强 | |
| D. | 新制氯水应避光保存 |
分析 A.氯水是氯气溶于水得到的水溶液;
B.氯水呈酸性且氯水含有次氯酸具有漂白性;
C.久置的氯水是盐酸;
D.根据氯水中的次氯酸见光易分解解答;
解答 解:A.氯水是氯气溶于水得到的水溶液,故A正确;
B.因氯水中含有的微粒:离子:Cl-、H+、OH-、ClO-,分子:HClO、H2O、Cl2,氯水呈酸性,新制氯水中含次氯酸,次氯酸具有强氧化性,具有漂白作用,所以在pH试纸上滴新制氯水,试纸会先变红后褪色,故B正确;
C.Cl2+H2O?HCl+HClO,生成的次氯酸见光分解,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以久置的氯水是盐酸,漂白能力减弱,故C错误;
D.Cl2+H2O?HCl+HClO,生成的次氯酸见光分解,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,促进平衡正向进行,故氯水宜保存在低温、避光条件下,保存在棕色细口瓶中,故D正确;
故选C.
点评 本题考查氯气的性质和氯水的成分,明确氯水中各成分的性质是解答本题的关键,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
8.1.52g铜镁合金完全溶解50mL密度为1.40g•ml-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 得到2.54g沉淀时,加入Na0H溶液的体积是600ml | |
| B. | 该浓硝酸稀释至100mL时,HNO3的物质的量浓度是7mol•L-1 | |
| C. | 该合金中镁与铜的质量之比是3:16 | |
| D. | NO2和N2O4的混合气体中,N2O4的物质的量是0.01mol |
9.下列反应中不可能设计成原电池的是( )
| A. | NaOH+HCl═NaCl+H2O | B. | 2Fe3++Fe═3Fe2+ | ||
| C. | Zn+2HCl═ZnCl2+H2↑ | D. | 4Al+3O2+6H2O═4Al(OH)3↓ |
6.0.1mol/L的NH3•H2O溶液中存在平衡:NH3•H2O?NH4++OH-,下列说法正确的是( )
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 加入少量氢氧化钠固体,溶液中c(OH-)减小 | |
| C. | 通入少量HCl气体,平衡向正反应方向移动 | |
| D. | 加入少量NH4Cl固体,平衡向正反应方向移动 |
13.工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )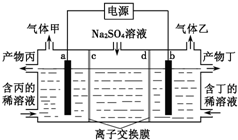

| A. | a极与电源的负极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阴离子交换膜 | |
| D. | 每转移0.1mol e-则产生1.12L气体乙 |
10.一种熔融碳酸盐燃料电池原理示意如图.
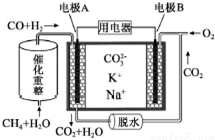
下列有关该电池的说法不正确的是( )

下列有关该电池的说法不正确的是( )
| A. | 电极A上H2参与的电极反应为:CO+H2+2CO32--4e-=3CO2+H2O | |
| B. | 理论上,A极每消耗1molH2,则消耗$\frac{1}{3}$molCH4 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
7.下列反应原理不符合工业冶炼金属实际情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ |
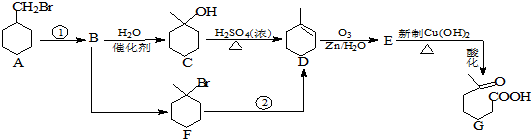
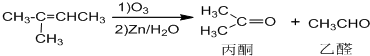
 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.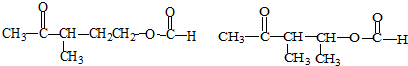
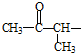 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应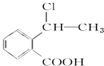 为原料制备
为原料制备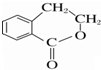 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.