题目内容
20.井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发生的反应:FeS2+H2O═Q+S+H2S↑ (已配平),则物质Q是( )| A. | Fe2O3 | B. | FeO | C. | Fe(OH)2 | D. | Fe(OH)3 |
分析 已知FeS2+H2O═Q+S+H2S↑,根据原子守恒和转移电子守恒分析.
解答 解:已知FeS2+H2O═Q+S+H2S↑,反应中S元素即失电子又得到电子,Fe的化合价不变,所以由原子守恒可知,Q为FeS,故B正确;
故选B.
点评 本题考查了氧化还原反应,注意把握原子守恒和得失电子守恒,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
10.下列各组中两种有机物,不符合以下条件的是( )
无论以何种比例混合,只要混合物总质量不变,完全燃烧时生成水的质量不变.
无论以何种比例混合,只要混合物总质量不变,完全燃烧时生成水的质量不变.
| A. | CH2O C2H4O2 | B. | C2H4 C2H4O | C. | 乙烯 聚乙烯 | D. | C8H8 C4H8O3 |
11.化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列实验操作正确的是( )
| A. | 蒸馏液体时,冷水应从冷凝管的上端进入,下端流出,符合水往低处流原理 | |
| B. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧靠烧杯内壁 | |
| C. | 进行蒸发操作时,待固体全部析出时再停止加热 | |
| D. | 分液时,当静置分层后,打开旋塞,使下层液体流出,待下层液刚好流尽后,立即关闭旋塞,再换另一只烧杯,再打开旋塞,将上层液体流出 |
8.1.52g铜镁合金完全溶解50mL密度为1.40g•ml-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 得到2.54g沉淀时,加入Na0H溶液的体积是600ml | |
| B. | 该浓硝酸稀释至100mL时,HNO3的物质的量浓度是7mol•L-1 | |
| C. | 该合金中镁与铜的质量之比是3:16 | |
| D. | NO2和N2O4的混合气体中,N2O4的物质的量是0.01mol |
15.具有9个质子和10个电子的微粒是( )
| A. | Na+ | B. | O2- | C. | F- | D. | Ne |
5.下列有关乙酸和乙醇的叙述正确的是( )
| A. | 白醋的醋味源于乙醇 | B. | 米酒主要成分为乙酸 | ||
| C. | 二者均为无机物 | D. | 二者在一定条件下可发生反应 |
12.下列关于催化剂的说法,不正确的是( )
| A. | 催化剂不能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 任何化学反应,都需要催化剂 |
9.下列反应中不可能设计成原电池的是( )
| A. | NaOH+HCl═NaCl+H2O | B. | 2Fe3++Fe═3Fe2+ | ||
| C. | Zn+2HCl═ZnCl2+H2↑ | D. | 4Al+3O2+6H2O═4Al(OH)3↓ |
10.一种熔融碳酸盐燃料电池原理示意如图.
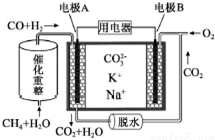
下列有关该电池的说法不正确的是( )

下列有关该电池的说法不正确的是( )
| A. | 电极A上H2参与的电极反应为:CO+H2+2CO32--4e-=3CO2+H2O | |
| B. | 理论上,A极每消耗1molH2,则消耗$\frac{1}{3}$molCH4 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |