题目内容
将KClO3、I2各0.02mol加入12g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发).将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),将过滤后的溶液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气.则A的化学式可能是( )
| A、IClO |
| B、ICl3 |
| C、I2Cl6 |
| D、KIO3 |
考点:化学方程式的有关计算
专题:计算题
分析:橙红色晶体A在常温下就有升华现象,是共价化合物,不含钾元素,根据K元素守恒,可知最终收集的KCl为0.02mol,根据质量守恒计算A的质量,再根据Cl原子守恒、I原子守恒确定A中n(Cl)、n(I),进而确定是否含有O元素,结合原子物质的量之比确定化学式.
解答:
解:橙红色晶体A在常温下就有升华现象,是共价化合物,不含钾元素,根据K元素守恒,可知最终收集的KCl为0.02mol,
根据质量守恒,可知A的质量=12g+0.02mol×122.5g/mol+0.02mol×254g/mol-8.7g-0.02mol×74.5g/mol=9.34g
根据Cl原子守恒,可知A中n(Cl)=0.02mol+
-0.02=0.12mol,根据I原子守恒确定A中n(I)=0.04mol,故m(Cl)+m(I)=0.12mol×35.5g/mol+0.04mol×127g/mol=9.34g,故A不含O元素,只由Cl、I两种元素组成,且n(I):n(Cl)=0.04mol:0.12mol=1:3,故选项中BC符合,
故选BC.
根据质量守恒,可知A的质量=12g+0.02mol×122.5g/mol+0.02mol×254g/mol-8.7g-0.02mol×74.5g/mol=9.34g
根据Cl原子守恒,可知A中n(Cl)=0.02mol+
| 12g×36.5% |
| 36.5 |
故选BC.
点评:本题考查方程式的有关计算,注意利用守恒思想进行解答,难度中等.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
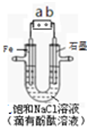 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、1mol NH3含有的电子数10NA |
| C、常温常压下,22.4L的氧气含氧原子数为2NA |
| D、常温下,1L 0.1mol?L-1 AlCl3溶液中含Al3+数为0.1NA |
下列说法正确的是( )
A、硝基苯的结构简式为 |
B、表示甲烷分子或四氯化碳分子的比例模型 |
| C、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D、结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
 已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-→2Fe2++I2 |
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
| D、根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1mol |
利用下列实验装置能完成相应实验的是( )


| A、图1装置模拟铁的吸氧腐蚀 |
| B、图2装置制取并吸收NH3 |
| C、图3装置量取8.5mL的稀硫酸 |
| D、图4装置制取少量乙酸乙酯 |

 依据某氧化还原反应设计的原电池如图所示.
依据某氧化还原反应设计的原电池如图所示.