题目内容
下列说法正确的是( )
A、硝基苯的结构简式为 |
B、表示甲烷分子或四氯化碳分子的比例模型 |
| C、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D、结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
考点:结构简式,球棍模型与比例模型,化学方程式的有关计算
专题:有机物分子组成通式的应用规律
分析:A、硝基苯中的硝基中的氮原子与苯环上的碳原子相连,不是与氧原子相连;
B、 可以表示甲烷的比例模型;四氯化碳中Cl原子的原子半径大于C原子;
可以表示甲烷的比例模型;四氯化碳中Cl原子的原子半径大于C原子;
C、苯的分子式为C6H6,苯甲酸的分子式为C6H5COOH,可以表示为:C6H6CO2,等物质的量的二者消耗的氧气的物质的量相等;
D、甲醛和苯酚发生缩聚反应可以生成
B、
 可以表示甲烷的比例模型;四氯化碳中Cl原子的原子半径大于C原子;
可以表示甲烷的比例模型;四氯化碳中Cl原子的原子半径大于C原子; C、苯的分子式为C6H6,苯甲酸的分子式为C6H5COOH,可以表示为:C6H6CO2,等物质的量的二者消耗的氧气的物质的量相等;
D、甲醛和苯酚发生缩聚反应可以生成
解答:
解:A、硝基苯中,硝基中的氮原子与碳原子相连,硝基苯的正确结构简式为: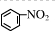 ,故A错误;
,故A错误;
B、比例模型应符合原子的实际大小,四氯化碳的比例模型中,氯原子的原子半径比碳原子的原子半径大,故B错误;
C、苯甲酸的分子式为C6H5COOH,可以表示为:C6H6CO2,燃烧时苯甲酸中消耗氧气的部分为:C6H6,所以等物质的量的苯和苯甲酸,二者消耗的氧气的物质的量相等,故C错误;
D、苯酚和甲醛发生缩聚反应得到酚醛树酯,酚醛树脂的结构片段为: ,故D正确;
,故D正确;
故选D.
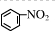 ,故A错误;
,故A错误;B、比例模型应符合原子的实际大小,四氯化碳的比例模型中,氯原子的原子半径比碳原子的原子半径大,故B错误;
C、苯甲酸的分子式为C6H5COOH,可以表示为:C6H6CO2,燃烧时苯甲酸中消耗氧气的部分为:C6H6,所以等物质的量的苯和苯甲酸,二者消耗的氧气的物质的量相等,故C错误;
D、苯酚和甲醛发生缩聚反应得到酚醛树酯,酚醛树脂的结构片段为:
 ,故D正确;
,故D正确;故选D.
点评:本题考查了结构简式、比例模型、缩聚反应等知识,题目难度中等,注意掌握有机物的结构简式、比例模型的表示方法,能够正确根据高聚物结构简式判断其单体.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
pH相同的等体积H2SO4、HF和CH3COOH三种溶液,分别滴加等浓度的NaOH溶液至恰好中和,消耗NaOH溶液的体积为V1、V2、V3,则三者的大小关系正确的是(已知Ka(HF)=6.8×10-4mol?L-1、Ka(CH3COOH)=1.7×10-5mol?L-1)( )
| A、V3>V2>V1 |
| B、V3=V2=V1 |
| C、V3>V2=V1 |
| D、V1=V2>V3 |
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如图.下列说法正确的是( )| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(OH-)>c(H+) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
在给定的4种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
| A、滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- |
| B、能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、pH为13的溶液:CO32-、SO32-、S2O32-、Na+ |
短周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型可能是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
将KClO3、I2各0.02mol加入12g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发).将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),将过滤后的溶液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气.则A的化学式可能是( )
| A、IClO |
| B、ICl3 |
| C、I2Cl6 |
| D、KIO3 |
下列有关实验的叙述,正确的是( )(选填字母序号).
| A、制备乙酸乙酯时,将乙醇和乙酸依次倒入到浓硫酸中 |
| B、用干燥且沽净的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上 |
| C、滴定管洗净后,经蒸馏水润洗即可注入标准液进行滴定 |
| D、铜片跟稀硝酸反应产生的气体可用排水法收集 |
| E、用浓氨水洗涤做过银镜反应的试管 |
| F、在溴水中滴入少量苯酚溶液有白色沉淀生成 |