题目内容
5.Cu2O广泛用作颜料和化工生产的催化剂.(1)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,有关转化如图1所示.
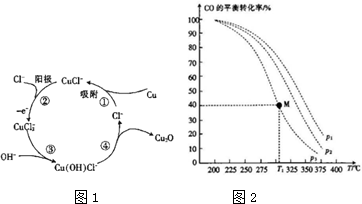
将得到的Cu2O溶于稀硫酸,发现有红色固体生成,该反应中氧化剂与还原剂的质量之比为1:1.图中③④两步反应的总反应离子方程式为2CuCl2+2OH-=Cu2O↓+4Cl-+H2O.
(2)Cu2O与ZnO绀成的催化剂可用于工业上含成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol,按$\frac{n({H}_{2})}{n(CO)}$=2的投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图2所示.
①图中压强p1、p2、p3由大到小的顺序是P1>P2>P3.
②a<0(填“>”或“<”)
③起始时,c(H2)=0.20mol•L-1,c(CO)=0.10mol•L-1,在p3及T1℃下反应CO(g)+2H2(g)═CH3OH(g)达到平衡,该温度下反应的平衡常数为46.3.
分析 (1)据Cu2O+H2SO4=Cu+CuSO4+H2O,此方程式分析元素的化合价,并据升失氧化还原剂,降低还原氧化剂,进行分析;据图1循环流程分析方程式;
(2)①由图可知,温度一定时,CO的转化率α(P1)<α(P2)<α(P3),据此结合方程式判断压强对平衡移动的影响进行解答;
②升高温度向吸热方向进行;
③k=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$进行计算.
解答 解:(1)Cu2O+H2SO4=Cu+CuSO4+H2O,Cu2O中Cu元素化合价从+1价,升高到+2价和降低到0价,故Cu2O既是还原剂有是氧化剂,故氧化剂与还原剂的质量之比为1:1,
据图1循环流程分析得反应物是CuCl2和OH-,生成物是Cu2O、Cl-和H2O,故方程式为2CuCl2+2OH-=Cu2O↓+4Cl-+H2O,
故答案为:1:1;2CuCl2+2OH-=Cu2O↓+4Cl-+H2O;
(2)①由图可知,温度一定时,CO的转化率α(P3)<α(P2)<α(P1),该正反应是气体体积减小的反应,增大压强平衡向正反应进行,CO的转化率升高,故压强P1>P2>P3,
②升高温度向吸热方向进行;从图象来看温度升高CO的转化率降低,故向逆反应方向进行,故逆反应吸热,则正反应放热,故a<0,故答案为:<;
故答案为:P1>P2>P3;<;
③n变(CO)=0.1mol/L×40%=0.04mol/L,
CO(g)+2H2(g)═CH3OH(g)
开始(c) 0.10 0.20 0
变化 0.04 0.08 0.04
结束 0.06 0.12 0.04
k=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.04}{0.06×0.1{2}^{2}}$=46.3,
故答案为46.3.
点评 本题考查的知识点较多,平衡常数、反应速率的计算、外界条件对化学平衡移动的影响等,综合性较强.

 阅读快车系列答案
阅读快车系列答案| A. | N2、H2的浓度之比保持不变 | |
| B. | N2和H2的反应速率之比为1:3 | |
| C. | NH3的生成速率与H2的生成速率之比为2:3 | |
| D. | 体系中N2、H2、NH3的分子个数之比为1:3:2 |
| A. | 1:5 | B. | 1:4 | C. | 3:2 | D. | 5:1 |
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | 非金属性:Cl>C>Si |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 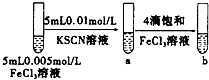 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| A. | V=150 mL | B. | m1=14.6g | ||
| C. | 白色沉淀最大量为15.6g | D. | m2=10.2g |
| A. | 玻璃属于非金属材料,其主要成分是碳酸盐 | |
| B. | 玻璃钢是一种复合材料,由塑料和铁丝复合而成 | |
| C. | 有机物合成材料属于高分子材料,在汽车轮胎、棉花、塑料制品中都存在 | |
| D. | 氮化硅陶瓷是新型无机非金属材料 |