题目内容
8.还原铁粉是化工生产及实验室中常用的还原剂,工业上以绿矾为原料制备还原铁粉的工艺如图1: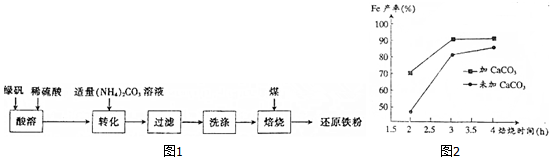
回答下列问题:
(1)酸溶过程中硫酸的作用是抑制Fe2+水解.
(2)转化的目的是制得FeCO3,加液时应将碳酸铵溶液加人到FeSO4中,原因是防止生成氢氧化亚铁.
(3)转化过程中温度不超过35℃,原因是防止碳酸铵受热分解
(4)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取少量最后一次洗涤液于试管,滴入盐酸酸化的BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净.
(5)将FeCO3浊液暴露在空气中,固体表面变为红褐色,同时释放CO2,写出该反应的化学方程式4FeCO3+6H2O+O2=4Fe(OH)3+4CO2.
(6)在焙烧过程中需加入CaCO3进行脱硫处理.如图2为加CaCO3和不加CaCO3对还原铁粉产率的影响,据图分析CaCO3的另一作用为分解产生CO2与C反应生成还原剂CO.
分析 将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2,C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,CO+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2
最终制得还原铁粉:
(1)硫酸亚铁易水解而使其溶液呈酸性,酸能抑制亚铁离子水解;
(2)在碱性条件下,FeSO4容易生成氢氧化亚铁;
(3)考虑碳酸铵受热易分解;
(4)生成的FeCO3沉淀表面有硫酸根离子,检验洗涤液中是否含有硫酸根离子可判断沉淀是否洗涤干净;
(5)FeCO3浊液暴露在空气中,固体表面变为红褐色,同时释放CO2,说明与氧气生成了氢氧化铁和二氧化碳,根据质量守恒可得;
(6)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳.
解答 解:(1)硫酸亚铁是强酸弱碱盐,易水解而使其溶液呈酸性,向溶液中加入酸能抑制亚铁离子水解,所以用稀硫酸代替水溶解绿矾;
故答案为:抑制Fe2+水解;
(2)碱性条件下,FeSO4容易生成氢氧化亚铁,将碳酸铵溶液加人到FeSO4中为了防止生成氢氧化亚铁;
故答案为:防止生成氢氧化亚铁;
(3)碳酸铵受热易分解,故转化过程中温度不超过35℃;
故答案为:防止碳酸铵受热分解;
(4)FeCO3沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀,如果沉淀已经洗涤干净,则其洗涤液中不含硫酸根离子,其检验方法是:取少量最后一次洗涤液于试管,滴入盐酸酸化的BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净;
故答案为:取少量最后一次洗涤液于试管,滴入盐酸酸化的BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净;
(5)FeCO3浊液暴露在空气中,固体表面变为红褐色为氢氧化铁,同时释放CO2,反应的化学方程式为:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2;
故答案为:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2;
(6)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以加入碳酸钙能增加一氧化碳的含量,则还原铁粉的产率增大,
故答案为:分解产生CO2与C反应生成还原剂CO.
点评 本题考查物质的制备,涉及物质的分离提纯、离子的检验、实验条件的控制等,题目难度中等,关键是明确制备原理及化学实验基本操作.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 通过蒸馏,分离苯和硝基苯的混合物 | |
| B. | 电解AlCl3,可得金属铝 | |
| C. | 将MgCl2溶液蒸干,可得无水MgCl2 | |
| D. | 用过滤的方法,从碘水中提取碘 |
| A. | 5mL | B. | 10mL | C. | 15mL | D. | 20mL |
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
| 不纯物质 | 除杂试荆 | 分离方法 | |
| A | NH4Cl溶液(AlCl3) | NaOH溶液 | 过滤 |
| B | 蛋白质溶液(NaCl) | 蒸馏水 | 渗析 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| D | 四氯化碳(I2) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 玻璃 | B. | 纤维素 | C. | 天然油脂 | D. | 冰水混合物 |