题目内容
5.下列说法正确的是( )| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
分析 A.在水溶液中或熔融状态下自身电离出离子导电的化合物为电解质;
B.电离常数只与温度有关;
C.氯水中存在:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应;
D.HF属于弱电解质,加水不断稀释时,电离程度增大,但是电离平衡常数不变.
解答 解:A.在水溶液中或熔融状态下自身电离出离子导电的化合物为电解质,二氧化硫溶于水和水反应生成亚硫酸是电解质导电,二氧化硫是非电解质,故A错误;
B.向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,但是电离常数只与温度有关,所以一水合氨的电离常数不变,故B错误;
C.氯水中存在:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应,则平衡向正方向移动,所以溶液中c(HClO)增大,故C正确;
D.因为因Ka(HF)=$\frac{c({H}^{+})×c({F}^{-})}{c(HF)}$,当HF溶液加水不断稀释,促进电离,c(F-)不断减小,温度不变,Ka(HF)不变,所以$\frac{c({H}^{+})}{c(HF)}$增大,故D错误.
故选C.
点评 本题考查了电解质的概念、平衡的移动、电离常数的影响因素和计算,题目综合性强,难度中等,D选项为易错项,注意判断离子浓度变化时,可以借助于平衡常数表达式,运用整体法判断.

练习册系列答案
相关题目
15.K2Cr2O7+14HCl (浓)═2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6mol/L)反应,MnO2需和浓盐酸(>8mol/L)反应.根据以上信息,下列结论中不正确的是( )
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
16.常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-10,下列叙述正确的是( )
| A. | 溶液中水电离出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 与0.05 mol•L-1 NaOH溶液等体积混合,水的电离平衡向正向移动 | |
| D. | 上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大 |
13.下列反应中,HCl只作还原剂的是( )
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
10.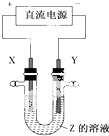 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
17.下面有关Na2CO3与NaHCO3的性质说法错误的是( )
| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 不可用氢氧化钙鉴别两者 | |
| C. | 两溶液碱性相同时的浓度:Na2CO3>NaHCO3 | |
| D. | 与同浓度的硫酸溶液反应放出气泡的快慢程度:NaHCO3>Na2CO3 |
14.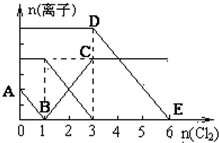 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2═2Fe3++I2+4Cl━ |
15.下列各组中的反应(反应在溶液中进行),可用同一离子方程式表示的是( )
| A. | NaOH+HCl与KOH+CH3COOH | B. | NaOH+H2SO4与 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4与Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 与Na2CO3+HCl |
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.