题目内容
17.下面有关Na2CO3与NaHCO3的性质说法错误的是( )| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 不可用氢氧化钙鉴别两者 | |
| C. | 两溶液碱性相同时的浓度:Na2CO3>NaHCO3 | |
| D. | 与同浓度的硫酸溶液反应放出气泡的快慢程度:NaHCO3>Na2CO3 |
分析 A、NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解;
B、Na2CO3与NaHCO3和氢氧化钙反应产生白色的沉淀碳酸钙;
C、碳酸根离子的水解程度大于碳酸氢根离子的水解程度;
D、与酸反应时,NaHCO3反应剧烈,碳酸钠和少量的酸反应得到碳酸氢钠.
解答 解:A.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热稳定,所以热稳定性:NaHCO3<Na2CO3,故A正确;
B、Na2CO3与NaHCO3和氢氧化钙反应都会产生白色的沉淀碳酸钙,无法用氢氧化钙鉴别两者,故B正确;
C、碳酸根离子的水解程度大于碳酸,氢钠的水解程度两溶液碱性相同时的浓度:Na2CO3<NaHCO3,故C错误;
D、分别滴加硫酸溶液,碳酸钠反应离子方程式为CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故D正确;
故选C.
点评 本题考查Na2CO3和NaHCO3性质,题目难度不大,注意把握Na2CO3和NaHCO3性质的异同,注重基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
12.(1)不同温度下水的离子积常数如表所示:
请用文字解释随温度升高水的离子积增大的原因:水电离吸热,升高温度后平衡正向移动;
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
向NaCN溶液中通入少量CO2,所发生反应的化学方程式为CO2+H2O+NaCN═NaHCO3+HCN.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
9.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
6.炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量.相关加成反应如下:
① (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1
②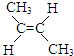 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2
(1)已知反应①、反应②平衡常数k1、k2如下,下列叙述正确的是C;
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1═△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H═△H1-△H2(用△H1、△H2表示)
 (g)→
(g)→ (g)△H
(g)△H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为0.25mol•L-1•min-1
②该温度下,此反应平衡常数K=250(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
H2(g)+$\frac{1}{2}$O2(g)→H2O(l)△H═-285.8kJ•mol-1
CH3CH2CH3(g)+5O2(g)→3CO2(g)+4H2O(l)△H═-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
CH3CH=CH2(g)+H2(g)→CH3CH2CH3(g)△H═-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为CH3CH=CH2(g)+$\frac{9}{2}$O2(g)=3CO2(g)+3H2O(l)△H=-2054.6kJ•mol-1.
①
 (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1②
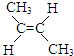 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2(1)已知反应①、反应②平衡常数k1、k2如下,下列叙述正确的是C;
| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
B.反应①、反应②都是丙烯加氢,所以△H1═△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H═△H1-△H2(用△H1、△H2表示)
 (g)→
(g)→ (g)△H
(g)△H(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为0.25mol•L-1•min-1
②该温度下,此反应平衡常数K=250(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
H2(g)+$\frac{1}{2}$O2(g)→H2O(l)△H═-285.8kJ•mol-1
CH3CH2CH3(g)+5O2(g)→3CO2(g)+4H2O(l)△H═-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
CH3CH=CH2(g)+H2(g)→CH3CH2CH3(g)△H═-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为CH3CH=CH2(g)+$\frac{9}{2}$O2(g)=3CO2(g)+3H2O(l)△H=-2054.6kJ•mol-1.


 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
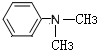 (写结构简式).
(写结构简式).