题目内容
13.已知:①CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(l)△H=-a kJ/mol②2C(s)+O2(g)=2CO(g)△H=-b kJ/mol
③C(s)+CO2(g)=2CO(g)△H=+c kJ/mol
且a、b、c均大于0,则甲烷的燃烧热(△H)为( )
| A. | -(a+$\frac{b}{2}$+c)kJ/mol | B. | +(a+$\frac{b}{2}$+c)kJ/mol | C. | -(2a+b+2c)kJ/mol | D. | +(2a+b+2c)kJ/mol |
分析 由①CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(l)△H=-a kJ/mol
②2C(s)+O2(g)=2CO(g)△H=-b kJ/mol
③C(s)+CO2(g)=2CO(g)△H=+c kJ/mol
结合盖斯定律可知,①+$\frac{②}{2}$-③得到CH4(g)+2O2(g)=CO2(g)+2H2O(l),以此来解答.
解答 解:由①CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(l)△H=-a kJ/mol
②2C(s)+O2(g)=2CO(g)△H=-b kJ/mol
③C(s)+CO2(g)=2CO(g)△H=+c kJ/mol
结合盖斯定律可知,①+$\frac{②}{2}$-③得到CH4(g)+2O2(g)=CO2(g)+2H2O(l),则甲烷的燃烧热△H=-(a+$\frac{b}{2}$+c)kJ/mol,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应的关系、焓变的计算为解答的关键,侧重分析与计算能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
3.沼气是一种能源,它的主要成分是 CH4,0.5mol CH4完全燃烧生成 CO2和 液态水时,放出 445kJ热量,则下列热化学方程式中正确的是( )
| A. | 2CH4(g)+4O2(g)→2CO2(g)+4H2O(1);△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+445kJ•mol-1 | |
| C. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+890kJ•mol-1 | |
| D. | $\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1);△H=-445kJ•mol-1 |
4.一定质量的铁和足量的稀硝酸或浓硝酸完全反应(还原产物为NO或NO2)在相同条件下,用排水集气法收集产生的气体.下列叙述一定正确的是
①硝酸浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Fe(NO3)3的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同( )
①硝酸浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Fe(NO3)3的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同( )
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①②③ |
1.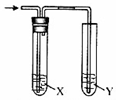 用图所示装置进行相关实验,能达到实验目的是( )
用图所示装置进行相关实验,能达到实验目的是( )
 用图所示装置进行相关实验,能达到实验目的是( )
用图所示装置进行相关实验,能达到实验目的是( )| 实验 | 试剂X | 试剂Y | |
| A | 检验乙醇与浓硫酸共热产生的乙烯 | NaHSO3溶液 | KMnO4酸性溶液 |
| B | 检验CO2和SO2混合气体中的CO2 | 品红溶液 | 澄清的石灰水 |
| C | 除去Cl2中混有的HCl,并验证Cl2的漂白性 | 饱和NaCl溶液 | 品红溶液 |
| D | 通入 HCl,验证非金属性Cl>C>Si | NaHCO3溶液 | Na2 SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
5.25℃时,向1.0mol•L-1氨水中加水,随着水量的增加而减小的是( )
| A. | NH3•H2O的电离度 | B. | c(H+) | C. | 电离平衡常数K碱 | D. | c(NH4+) |
2.下列说法正确的是( )
| A. | 氯气是一种紫色重要的化工原料 | |
| B. | 钠和钾的合金在常温下是固体 | |
| C. | 用二氧化硅具有很强的导光能力,可用于制作光缆 | |
| D. | 发酵粉中含有碳酸钠,能使焙制出的糕点疏松多孔 |
 B.
B.
 D.
D.