题目内容
18.海藻中富含碘元素.某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如图.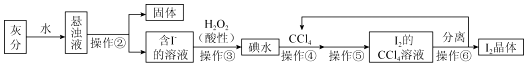
已知:碱性条件,3I2+6NaOH═5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4═3Na2SO4+3I2+H2O.
(1)指出提取碘的过程中有关的实验操作名称:②过滤、⑤萃取分液.
(2)操作④选用CCl4的理由是ABCD.
A.CCl4不溶于水C.CCl4的密度与水不同
C.碘在CCl4中比在水中溶解度更大D.CCl4与碘水不反应
(3)操作⑥中分离的方法I2和CCl4有两种:
法一:用NaOH浓溶液与溶解在CCl4中的I2反应,分液后再加稀硫酸使I2晶体析出.
操作过程如下,请填写相关空格:
①向装有I2的CCl4溶液的分液漏斗(填仪器名称)中加入少量1mol•L-1NaOH溶液;
②振荡至溶液的紫红色消失,静置、分层,则下(填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的上(填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1mol•L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
法二:可用蒸馏法分离I2和CCl4.
(4)本实验中可以循环利用的物质是CCl4.
(5)操作③反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O,该反应属于氧化还原反应.
分析 流程分析可知,灰分加水溶解浸泡后过滤的含I-的溶液,加入酸性过氧化氢氧化得到碘水,加入四氯化碳萃取后分液、分离得到碘晶体,四氯化碳循环使用,
(1)分析流程可知操作②是分离固体和液体,操作⑤是分离互不相溶的液体用萃取分液方法分离;
(2)萃取分液选取不溶于水的有机溶剂,碘单质在其中溶解度大于水中且不与碘水反应;
(3)①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
②振荡至溶液紫红色消失,碘单质和氢氧化钠反应,静置分层,四氯化碳密度 大在下层;
③含碘的碱溶液从分液漏斗上口倒出;
法二:分离I2和CCl4用蒸馏方法,
(4)参与实验过程,最后重新生成的物质可以循环使用;
(5)操作③反应是过氧化氢氧化碘离子生成碘单质;
解答 解:流程分析可知,灰分加水溶解浸泡后过滤的含I-的溶液,加入过氧化氢氧化得到碘水,加入四氯化碳萃取后分液、分离得到碘晶体,四氯化碳循环使用;
(1)分析流程可知操作②是分离固体和液体,实验操作为过滤,操作⑤是分离互不相溶的液体用分液方法分离,实验操作为萃取分液,
故答案为:过滤;萃取分液;
(2)操作④选用CCl4的理由是CCl4不溶于水,CCl4的密度与水不同,碘在CCl4中比在水中溶解度更大,CCl4与碘水不反应,
故答案为:ABCD;
(3)法一:用NaOH浓溶液与溶解在CCl4中的I2反应,分液后再加稀硫酸使I2晶体析出
①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
故答案为:分液漏斗;
②振荡碘单质和氢氧化钠反应,至溶液紫红色消失,静置分层,四氯化碳密度大在分液漏斗的下层,从下层放出,
故答案为:紫红;下;
③含碘的碱溶液从分液漏斗上口倒出,故答案为:上;
法二:可用蒸馏法分离I2和CCl4,故答案为:蒸馏;
(4)参与实验过程,最后重新生成的物质可以循环使用,流程分析可知四氯化碳可以循环使用,故答案为:CCl4 ;
(5)操作③反应是过氧化氢酸性溶液中氧化碘离子生成碘单质,反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O,反应为氧化还原反应,
故答案为:H2O2+2I-+2H+=I2+2H2O;氧化还原.
点评 本题考查了流程分析,混合物分离方法和提纯的实验过程分析,掌握基础是关键,题目难度中等.

①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤(NH4)2CO3.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═HSO3-+NH4+ | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 向含0.1mol•L-1Na2CO3和0.2mol•L-1NaOH的混合溶液中加入等体积的0.15mol•L-1的硫酸:CO32-+3H++2OH-═2H2O+HCO3- |
②2C(s)+O2(g)=2CO(g)△H=-b kJ/mol
③C(s)+CO2(g)=2CO(g)△H=+c kJ/mol
且a、b、c均大于0,则甲烷的燃烧热(△H)为( )
| A. | -(a+$\frac{b}{2}$+c)kJ/mol | B. | +(a+$\frac{b}{2}$+c)kJ/mol | C. | -(2a+b+2c)kJ/mol | D. | +(2a+b+2c)kJ/mol |
| 组号 | 反应温度 /℃ | 参加反应物质 | ||||
| KMnO4 | H2C2O4 | MnSO4 | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | m/g | ||
| A | 20 | 4 | 0.1 | 2 | 0.1 | 0 |
| B | 20 | 4 | 0.1 | 2 | 0.1 | 0.1 |
| C | 40 | 4 | 0.1 | 2 | 0.1 | 0 |
| D | 40 | 4 | 0.1 | 2 | 0.2 | 0.1 |
| A. | A | B. | B | C. | C | D. | D |
| A. | HCl、H2SO4、NaOH | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NH3•H2O | D. | HCl、NH3•H2O、H2SO4 |