题目内容
科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
(1)如果将CO2和H2以1:4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源.请完成以下化学方程式:CO2+4H2→ +2H2O
(2)若将CO2和H2以1:3的比例混合,使之发生反应生成某种重要的化工原料和水,则生成的该重要化工原料可能是 (填字母).
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(3)二氧化碳“组合转化”的某烷烃碳架结构如图所示: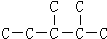 ,此烷烃的一溴代物有 种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为 ,用系统命名法命名该炔烃为
,此烷烃的一溴代物有 种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为 ,用系统命名法命名该炔烃为
(4)某烃蒸气完全燃烧时,消耗2.5倍于其体积的O2,产生等于其体积的水蒸气(体积均在相同条件下测定).该烃的结构式为 ,写出实验室制取该烃的化学方程式 .
(1)如果将CO2和H2以1:4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源.请完成以下化学方程式:CO2+4H2→
(2)若将CO2和H2以1:3的比例混合,使之发生反应生成某种重要的化工原料和水,则生成的该重要化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(3)二氧化碳“组合转化”的某烷烃碳架结构如图所示:
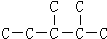 ,此烷烃的一溴代物有
,此烷烃的一溴代物有(4)某烃蒸气完全燃烧时,消耗2.5倍于其体积的O2,产生等于其体积的水蒸气(体积均在相同条件下测定).该烃的结构式为
考点:有机物的结构和性质,有关有机物分子式确定的计算
专题:有机物的化学性质及推断,烃及其衍生物的燃烧规律
分析:(1)根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式;
(2)化学变化中,变化前后原子种类、个数不变;根据CO2和H2混合气体发生反应的分子数比1:3及生成水的组成与分子构成,结合选项所传递的关于化工原料由C、H元素组成的信息,推断生成的化工原料的分子中C、H原子的个数比;
(3)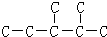 分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,若此烷烃为单烯烃加氢制得则相邻的碳原子上均至少有1氢原子;
分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,若此烷烃为单烯烃加氢制得则相邻的碳原子上均至少有1氢原子;
(4)由CxHy+2.5O2
H2O+xCO2及原子守恒分析.
(2)化学变化中,变化前后原子种类、个数不变;根据CO2和H2混合气体发生反应的分子数比1:3及生成水的组成与分子构成,结合选项所传递的关于化工原料由C、H元素组成的信息,推断生成的化工原料的分子中C、H原子的个数比;
(3)
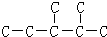 分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,若此烷烃为单烯烃加氢制得则相邻的碳原子上均至少有1氢原子;
分子中有6中氢原子,故一溴代物有 6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,若此烷烃为单烯烃加氢制得则相邻的碳原子上均至少有1氢原子;(4)由CxHy+2.5O2
| 点燃 |
解答:
解:(1)根据质量守恒定律的微观解释可以知道:反应前后的原子数目和种类应该相等,分析题给的化学反应方程式可以知道,反应前出现了2个O,1个C,8个H,反应后出现了2个O,4个H,所以在X中含有4个H和1个C,
故答案为:CH4;
(2)由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料;
通过以上分析,可得出化工原料中C、H原子个数比应为1:2;由烷烃CH4中C、H原子个数比为1:4,炔烃C2H2中C、H原子个数比为1:1,烯烃C2H4中C、H原子个数比为1:2,芳香烃C6H6中C、H原子个数比为1:1可知,只有烯烃符合,
故答案为:B;
(3)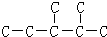 分子中有6中氢原子,故一溴代物有6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,则此炔烃的结构简式为
分子中有6中氢原子,故一溴代物有6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,则此炔烃的结构简式为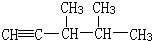 ,其名称为3,4-二甲基-1-戊炔,
,其名称为3,4-二甲基-1-戊炔,
故答案为:6;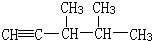 ;3,4-二甲基-1-戊炔;
;3,4-二甲基-1-戊炔;
(4)烃蒸气完全燃烧时,消耗2.5倍于其体积的O2,产生等于其体积的水蒸气,则CxHy+2.5O2
H2O+xCO2,由原子守恒可知,y=2,x=2,烃为乙炔,结构式为H-C≡C-H,实验室制取该烃的化学方程式为CaC2+H2O→Ca(OH)2+CH≡CH↑,
故答案为:H-C≡C-H;CaC2+H2O→Ca(OH)2+CH≡CH↑.
故答案为:CH4;
(2)由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料;
通过以上分析,可得出化工原料中C、H原子个数比应为1:2;由烷烃CH4中C、H原子个数比为1:4,炔烃C2H2中C、H原子个数比为1:1,烯烃C2H4中C、H原子个数比为1:2,芳香烃C6H6中C、H原子个数比为1:1可知,只有烯烃符合,
故答案为:B;
(3)
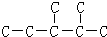 分子中有6中氢原子,故一溴代物有6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,则此炔烃的结构简式为
分子中有6中氢原子,故一溴代物有6种,若此烃为炔烃加氢制得,则相邻的碳原子上均至少有2个氢原子,只有左边的碳碳键符合,则此炔烃的结构简式为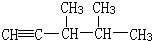 ,其名称为3,4-二甲基-1-戊炔,
,其名称为3,4-二甲基-1-戊炔,故答案为:6;
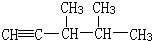 ;3,4-二甲基-1-戊炔;
;3,4-二甲基-1-戊炔;(4)烃蒸气完全燃烧时,消耗2.5倍于其体积的O2,产生等于其体积的水蒸气,则CxHy+2.5O2
| 点燃 |
故答案为:H-C≡C-H;CaC2+H2O→Ca(OH)2+CH≡CH↑.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重有机物结构及分析推断能力的综合考查,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
某锂电池的工作原理为LiMOx+Cn=Li1-yMOx+LiyCn(其中M为:Co、Mn、Ni).Li的化合物始终为+1甲,某一极的电极反应式为:LiMOx-ye-=Li1-yMOx+yLi+,则下列说法不正确的是( )
| A、该电池工作时是把化学能转化为电能 |
| B、LiMOx是该电池的负极 |
| C、其正极反应方程式为:LiyCn-ye-=Cn+yLi+ |
| D、手机往往使用锂电池的原因之一为锂是最轻的金属 |
溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为:IBr+H2O→HBr+HIO,下列关于IBr的叙述不正确的是( )
| A、IBr是双原子分子 |
| B、在很多反应中IBr是氧化剂 |
| C、和水反应时IBr既是氧化剂又是还原剂 |
| D、和NaOH反应时生成NaBr、NaIO和H2O |
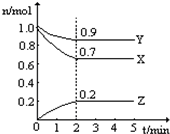 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 消去反应制备Ⅰ的化学方程式为
消去反应制备Ⅰ的化学方程式为 能与CO2发生类似反应②的反应,生成化合物Ⅴ的结构简式:
能与CO2发生类似反应②的反应,生成化合物Ⅴ的结构简式: 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,下列关于Ⅵ和Ⅶ的说法正确的有
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,下列关于Ⅵ和Ⅶ的说法正确的有
