题目内容
溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为:IBr+H2O→HBr+HIO,下列关于IBr的叙述不正确的是( )
| A、IBr是双原子分子 |
| B、在很多反应中IBr是氧化剂 |
| C、和水反应时IBr既是氧化剂又是还原剂 |
| D、和NaOH反应时生成NaBr、NaIO和H2O |
考点:氯、溴、碘及其化合物的综合应用,氧化还原反应
专题:氧化还原反应专题,卤族元素
分析:IBr+H2O→HBr+HIO中没有元素的化合价变化,IBr中I为+1价,Br为-1价,以此来解答.
解答:
解:A.IBr分子中含I、Br原子,故A正确;
B.与金属反应时,IBr是氧化剂,故B正确;
C.和水反应时,没有元素的化合价变化,IBr既不是氧化剂又不是还原剂,故C错误;
D.由氯气与NaOH的反应可知,IBr和NaOH反应时生成NaBr、NaIO和H2O,故D正确;
故选C.
B.与金属反应时,IBr是氧化剂,故B正确;
C.和水反应时,没有元素的化合价变化,IBr既不是氧化剂又不是还原剂,故C错误;
D.由氯气与NaOH的反应可知,IBr和NaOH反应时生成NaBr、NaIO和H2O,故D正确;
故选C.
点评:本题考查类卤素物质的性质,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与迁移能力的考查,注意元素化合价的分析,题目难度不大.

练习册系列答案
相关题目
某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3.该氧化还原反应中的还原产物是( )
| A、NO |
| B、FeSO4 |
| C、Fe(NO3)3 |
| D、Fe2(SO4)3 |
已知元素的原子序数,可以推断元素原子的( )
①质子数 ②核电荷数 ③核外电子数 ④离子所带电荷数.
①质子数 ②核电荷数 ③核外电子数 ④离子所带电荷数.
| A、①③ | B、②③ |
| C、①②③ | D、②③④ |
下列说法正确的是( )
①由不同原子组成的纯净物一定是化合物;
②非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物;
③含金属元素的离子不一定都是阳离子;
④胆矾是纯净物,水泥是混合物
⑤一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路.
①由不同原子组成的纯净物一定是化合物;
②非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物;
③含金属元素的离子不一定都是阳离子;
④胆矾是纯净物,水泥是混合物
⑤一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路.
| A、①③④ | B、①②⑤ |
| C、②③④ | D、③④⑤ |
下列各反应的离子方程式中,正确的是( )
| A、铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag | ||
| B、硫酸铝溶液中加入过量的氨水:Al3++3 OH-═Al(OH)3↓ | ||
C、铁片放入过量的稀硝酸中:3Fe+8H++2N
| ||
| D、将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O═2Al(OH)4-+3H2↑ |
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是( )


| A、X为SO2气体,也可将SO2换成Na2SO3 |
| B、设备Y为蒸馏塔 |
| C、在提取溴的过程中一定有Br-被氧化 |
| D、工业上每获得1mol Br2,需要消耗Cl2的体积最多为22.4L(标准状态下) |
关于胶体和溶液的叙述中正确的是( )
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体加入电解质可产生沉淀,而溶液不能 |
| C、胶体不能通过滤纸,而溶液能通过滤纸 |
| D、胶体能够发生丁达尔效应,而溶液则不能 |
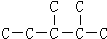 ,此烷烃的一溴代物有
,此烷烃的一溴代物有