题目内容
20.某同学采用硫铁矿焙烧取硫后的烧渣 (主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他 杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )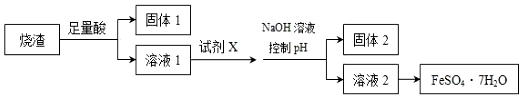
| A. | 溶解烧渣选用足量硫酸,试剂 X 选用铁粉 | |
| B. | 固体1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 | |
| C. | 从溶液 2 得到 FeSO4•7H2O 产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到 FeSO4•7H2O |
分析 硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,以此进行解答.
解答 解:硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,
A.由流程分析可知,溶解烧渣选用足量硫酸,X为铁粉,故A正确;
B.由流程分析可知,固体1中一定含有SiO2,调节pH值使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B正确;
C.亚铁离子易被空气中的氧气氧化,而且受热易失去结晶水,所以从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解,故C正确;
D.在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故D错误.
故选D.
点评 本题考查制备实验方案的设计与评价、工艺流程的分析应用,题目难度中等,侧重学生分析能力和创新能力的培养,注意把握常见物质的分离方法.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 可用细铁丝代替铂丝做焰色反应实验 | |
| B. | 容量瓶使用前须烘干 | |
| C. | 可用CCl4将溴水中的溴单质分离除净 | |
| D. | 用元素分析仪确定物质中含有哪些金属元素 |
11.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率,可采取的措施是( )
| A. | 加催化剂 | B. | 扩大容器体积 | C. | 升高温度 | D. | 增大压强 |
15.下列有关实验叙述及操作正确的是( )
| A. |  观察Fe(OH)2的生成 | |
| B. |  用图所示方法验证HCl气体易溶于水 | |
| C. |  用图定量测定H2O2的分解速率 | |
| D. |  记录滴定终点读数为12.20mL |
5.常温下,物质的量浓度均为0.1mol•L-1的下列四种溶液,其中pH最小的是( )
| A. | NaCl | B. | Ba(OH)2 | C. | NH4Al(SO4)2 | D. | Na3PO4 |
12.Li-SOCl2电池是迄今具有最高能量比的电池.该电池中锂为负极,碳棒为正极,无水四氯铝酸锂(LiAlCl4)的SOCl2溶液为电解液.电池总反应为电池的总反应可表示为:4Li+2SOCl2=4LiCl+SO2+S.下列说法不正确的是( )
| A. | 负极的电极反应式为 Li-e-=Li+ | |
| B. | 正极的电极反应式为2SOCl2+4e-=SO2+S+4Cl- | |
| C. | 若电解液中含有水,则该电池的效率将大大降低 | |
| D. | 若负极有14gLi参加反应,则理论上流过电路中的电子书约为1.204×1023 |
3.下列有关物质的性质、应用或制取的说法正确的是( )
| A. | 氯气通入石灰乳中,制取漂白粉 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 实验室保存氯化铁溶液时加少量盐酸,目的是防止Fe3+水解 | |
| D. | 常温下浓硝酸与铝、铁均不反应,可用铝或铁制的容器存放浓硝酸 |
4.如表为元素周期表的一部分.
请回答下列问题:
(1)Z元素在周期表中的位置为第三周期ⅤⅡA族.
(2)表中元素原子半径最大的非金属是(元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为C3H4.
(5)向氯化铝溶液中加入过量氨水,离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+.
(6)将SO2通入稀硝酸中,反应的离子方程式为3SO2+2H2O+2NO3-═3SO42-+2NO↑+4H+.
| 碳 | 氮 | Y | ||
| 铝 | X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期ⅤⅡA族.
(2)表中元素原子半径最大的非金属是(元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为C3H4.
(5)向氯化铝溶液中加入过量氨水,离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+.
(6)将SO2通入稀硝酸中,反应的离子方程式为3SO2+2H2O+2NO3-═3SO42-+2NO↑+4H+.