题目内容
8.用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是硅单质(或Si);光导纤维的主要成分是二氧化硅(或SiO2);过氧化钠在呼吸面具或潜水艇中作为氧气的来源,其CO2反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2;红热的铁跟水蒸气反应,反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用电解氯化钠溶液的方式制取氯气,反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.分析 计算机芯片的主要成分是硅;光导纤维的主要成分是二氧化硅;过氧化钠与二氧化碳反应生成氧气;红热的铁跟水蒸气反应生成四氧化三铁和氢气;工业上用电解氯化钠溶液的方式制取氯气,同时生成氢气和氢氧化钠.
解答 解:计算机芯片的主要成分是硅;光导纤维的主要成分是二氧化硅;过氧化钠与二氧化碳反应生成氧气,方程式为2Na2O2+2CO2═2Na2CO3+O2;红热的铁跟水蒸气反应生成四氧化三铁和氢气,方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用电解氯化钠溶液的方式制取氯气,同时生成氢气和氢氧化钠,反应的方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:硅单质(或Si); 二氧化硅(或SiO2);2Na2O2+2CO2═2Na2CO3+O2;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查物质的成分和用途,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意把握工业制备原理的理解应用,学习中注意知识的积累,题目难度不大.

练习册系列答案
相关题目
19.化学与社会、生活、技术和环境密切相关.下列有关说法中不正确的是( )
| A. | 有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热 | |
| B. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 苹果放在空气中久置变黄和纸张久置变黄原理不同 |
16.已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
3.下列说法正确的是( )
| A. | 常温常压下,16g O3所含的氧原子数目为NA | |
| B. | 标准状况下,O2的体积取决于O2分子间的距离 | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 若气体摩尔体积为22.4 L/mol,则所处条件为标准状况 |
13.下列有关化学用语表示正确的是( )
| A. | 氨气分子的电子式: | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
20.某同学采用硫铁矿焙烧取硫后的烧渣 (主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他 杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )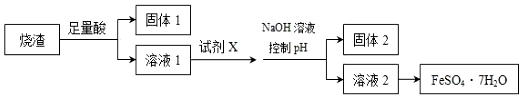

| A. | 溶解烧渣选用足量硫酸,试剂 X 选用铁粉 | |
| B. | 固体1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 | |
| C. | 从溶液 2 得到 FeSO4•7H2O 产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到 FeSO4•7H2O |
12.已知:H2(g)+F2(g)═2HF(g)△H=-546.6kJ•mol-1,下列说法中不正确的是( )
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
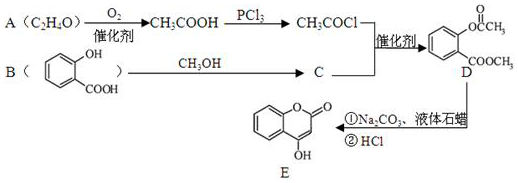
 .
.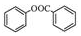 )的合成路线(无机原料任选).
)的合成路线(无机原料任选). .
.