题目内容
5.常温下,物质的量浓度均为0.1mol•L-1的下列四种溶液,其中pH最小的是( )| A. | NaCl | B. | Ba(OH)2 | C. | NH4Al(SO4)2 | D. | Na3PO4 |
分析 常温下,物质的量浓度均为0.1mol•L-1的溶液中,氢氧根的浓度越小,则氢离子浓度越大,则pH越小,据此分析.
解答 解:A、NaCl在溶液中不水解,故溶液显中性,即pH等于7;
B、Ba(OH)2是强碱,0.1mol/L氢氧化钡溶液中氢氧根的浓度为0.2mol/L,溶液显强碱性,即pH大于7;
C、NH4Al(SO4)2在溶液中水解显酸性,即pH小于7;
D、磷酸钠在溶液中水解显碱性,则pH大于7.
故选C.
点评 本题考查了溶液的酸碱性和pH的大小比较,难度不大,应注意的是酸溶液和强酸弱碱盐溶液显酸性,而碱溶液和强碱弱酸盐溶液显碱性.

练习册系列答案
相关题目
15.二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图:
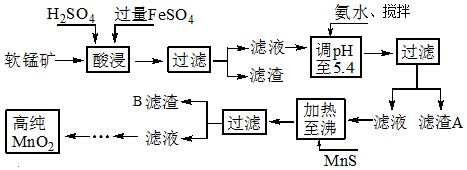
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.
16.已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
13.下列有关化学用语表示正确的是( )
| A. | 氨气分子的电子式: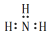 | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
20.某同学采用硫铁矿焙烧取硫后的烧渣 (主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他 杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )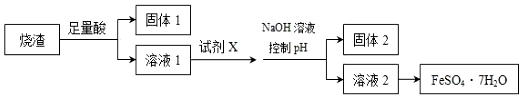

| A. | 溶解烧渣选用足量硫酸,试剂 X 选用铁粉 | |
| B. | 固体1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 | |
| C. | 从溶液 2 得到 FeSO4•7H2O 产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到 FeSO4•7H2O |
10.下列有关0.10mol•L-1的NH4Cl溶液的叙述不正确的是( )
| A. | c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-) | ||
| C. | c(NH4+)+c(H+)=c(Cl-)+c(OH-) | D. | c(NH4+)+c(NH3.H2O)=0.10mol•L-1 |
8.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 任何化学反应,都需要催化剂 |
9.下列实验能达到预期目的是( )
| A. | 向煮沸的 1 mol•L-1 NaOH 溶液中滴加 FeCl3饱和溶液制备 Fe(OH)3 胶体 | |
| B. | 向混有醋酸的乙酸乙酯中加入饱和 Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量醋酸 | |
| C. | 检验甲酸中是否含有甲酸丙酯时,可以往混合液中加入足量 NaOH 溶液以中和甲酸,再滴加银 氨溶液看是否产生银镜 | |
| D. | 用酸性高锰酸钾溶液除去乙烷中少量的乙烯 |
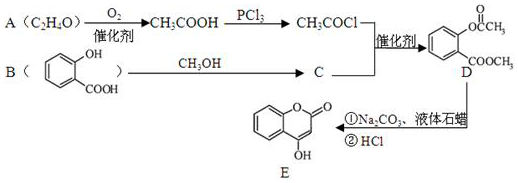
 .
.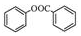 )的合成路线(无机原料任选).
)的合成路线(无机原料任选). .
.