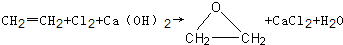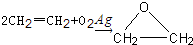题目内容
在2L密闭容器中把4molA和2mol B混合,在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g).2min后反应达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol/(L?min).则下列说法正确的是( )
| A、z=4 | ||
| B、B物质的转化率是20% | ||
| C、A的平衡浓度是1.6 mol/L | ||
D、平衡时气体压强是原来的
|
考点:化学平衡的计算
专题:
分析:根据反应速率之比等于化学计量数之比来确定化学计量数z,VD=0.2mol/(L?min),VC=
=0.4mol/(L?min),则z=4;
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化1.2 0.8 1.6 0.8
平衡2.8 1.2 1.6 0.8
结合转化率的概念及物质的量之比等于压强之比来计算.
| 1.6mol | ||
|
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化1.2 0.8 1.6 0.8
平衡2.8 1.2 1.6 0.8
结合转化率的概念及物质的量之比等于压强之比来计算.
解答:
解:根据反应速率之比等于化学计量数之比来确定化学计量数z,VD=0.2mol/(L?min),VC=
=0.4mol/(L?min),则z=4;
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化1.2 0.8 1.6 0.8
平衡2.8 1.2 1.6 0.8
A、计算可知z=4,故A正确;
B、B的转化率=
×100%=40%,故B错误;
C、A的平衡浓度=
=1.4mol/L,故C错误;
D、气体物质的量之比等于压强之比,平衡时气体压强是原来的
=
,故D错误;
故选A.
| 1.6mol | ||
|
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化1.2 0.8 1.6 0.8
平衡2.8 1.2 1.6 0.8
A、计算可知z=4,故A正确;
B、B的转化率=
| 0.8mol |
| 2mol |
C、A的平衡浓度=
| 2.8mol |
| 2L |
D、气体物质的量之比等于压强之比,平衡时气体压强是原来的
| 2.8mol+1.2mol+1.6mol+0.8mol |
| 4mol+2mol |
| 16 |
| 15 |
故选A.
点评:本题考查化学平衡的计算,熟悉化学平衡的三段法计算及转化率的计算即可解答,注意反应速率与化学计量数的关系、化学计量数与压强的关系来解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验室中需要配制2mol?L-1 NaOH的溶液450mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
| A、500mL,40g |
| B、500mL,36g |
| C、450mL,36g |
| D、450mL,40g |
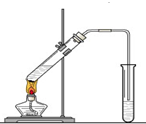 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: