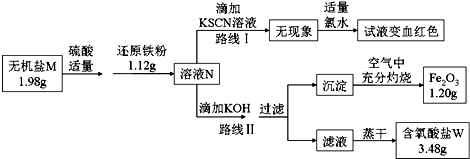
题目内容
1.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | lmol Na2O2晶体中共含有2NA个离子 | |
| B. | 0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 电解精炼铜时每转移NA个电子,阳极生成氧气 |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、一个氢氧化铝胶粒是多个氢氧化铝的聚集体;
C、氧气和臭氧均由氧原子构成;
D、电解精炼铜时,阳极上是粗铜放电.
解答 解:A、l mol Na2O2晶体中共含有2NA个Na+,NA个O22-离子,即共含3NA个离子,故A错误;
B、AlCl3发生水解得到氢氧化铝胶体,而氢氧化氯胶粒是由很多氢氧化铝形成的集合体,因此氢氧化铝胶粒数小于0.1NA,故B错误;
C、氧气和臭氧均由氧原子构成,即16g O2和O3混合气体含有16g O,则氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,即NA个,故C正确;
D、电解精炼铜时,阳极上是粗铜放电,生不成氧气,则D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
12.中美研究人员在新一期美国(环境科学与技术)杂志上报告说,黄粉虫可以吞食和完全降解塑料.他们已在黄粉虫体内分离出靠聚苯乙烯生存的细菌,并将其保存.聚苯乙烯属于( )
| A. | 合金 | B. | 硅酸盐材料 | C. | 有机高分子材料 | D. | 无机非金属材料 |
9.(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.已知18g液态水转化成水蒸气需吸热44kJ,则反应2H2(g)+O2(g)═2H2O(l)的△H=-571.6kJ•mol-1,氢气的标准燃烧热△H=-285.8kJ•mol-1.
(2)已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1.其它相关数据如下表:
则表中a为431.8.
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
(2)已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1.其它相关数据如下表:
| H2(g) | Cl2 (g) | HCl (g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 243 | a |
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
16.有一真空密闭容器中,盛有amolPCl5,加热到200℃时,发生如下反应PCl5(g)?PCl3(g)+Cl2(g),反应达平衡时,PCl5所占体积分数为M%,若在同一温度下,同一容器中,最初投入2amolPCl5反应达平衡时,PCl5所占体积分数为N%,则M与N的关系正确的是( )
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
13.下列过程属于还原反应的是( )
| A. | CO2→CO | B. | Zn→Zn2+ | C. | H2→H2O | D. | CuO→CuCl2 |
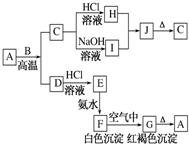 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解. 有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.
有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.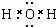 .
.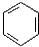 +CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$
+CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$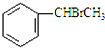 +H2O(卤烷基化反应)
+H2O(卤烷基化反应) +R′-X$\stackrel{一定条件}{→}$
+R′-X$\stackrel{一定条件}{→}$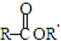 +NaX
+NaX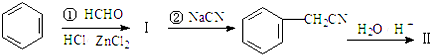 $\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)
$\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)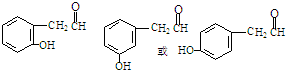 .
.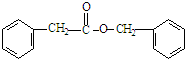 .
.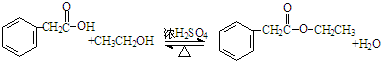 .
. .
.