题目内容
13.下列过程属于还原反应的是( )| A. | CO2→CO | B. | Zn→Zn2+ | C. | H2→H2O | D. | CuO→CuCl2 |
分析 氧化还原反应中,氧化剂发生还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.CO2→CO碳元素化合价降低,被还原,属于还原反应,故A正确;
B.Zn元素化合价升高,被氧化,属于氧化反应,故B错误;
C.H元素化合价升高,被氧化,属于氧化反应,故C错误;
D.元素化合价没有发生变化,属于复分解反应,故D错误.
故选A.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意把握氧化剂发生还原反应,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
3.下列叙述中不正确的是( )
| A. | 食盐加碘所添加的是碘酸钾 | |
| B. | 油脂既能为人体提供热量,又能提供人体必需脂肪酸 | |
| C. | 棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 | |
| D. | 蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
1.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | lmol Na2O2晶体中共含有2NA个离子 | |
| B. | 0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 电解精炼铜时每转移NA个电子,阳极生成氧气 |
8.下列说法中正确的是( )
| A. | 含H+的溶液一定呈酸性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(OH-)═c(H+)的溶液一定呈中性 | |
| D. | 水中加入硫酸恢复至室温后,Kw=c(H+)•c(OH-)将变大 |
5.结合下图判断,下列叙述正确的是( )
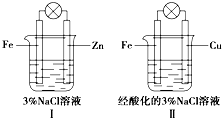

| A. | Ⅰ和Ⅱ中正极均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| D. | Ⅰ和Ⅱ中灯泡均会发亮 |
2.氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业.氯化亚铜(CuCl)是一种白色粉末,微溶于水、不溶于乙醇、稀硝酸及稀硫酸;可溶于氨水、浓盐酸,并生成配合物NH4[CuCI2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图1是实验室制备氯化亚铜的流程图及实验装置图如图2.

实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36qo盐酸15mL、水.
(1)反应①的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分.
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生02的速率,宜选择图3中的B(填字母序号)方案.
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是氯化铵溶于水吸收大量热量;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞,沿a或c(填字母)口倾出棕色反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题有防止CuCl被氧化,避光防止分解.
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0mol.L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表.
(已知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+═Fe3++Ce3+)
④数据处理:计算得CuCI的纯度为95%(平行实验结果相差不能超过0.3%)

实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36qo盐酸15mL、水.
(1)反应①的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分.
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生02的速率,宜选择图3中的B(填字母序号)方案.
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是氯化铵溶于水吸收大量热量;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞,沿a或c(填字母)口倾出棕色反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题有防止CuCl被氧化,避光防止分解.
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0mol.L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表.
(已知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+═Fe3++Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.65 | 24.75 | 24.70 |
3.下列有关化学用语,正确的是( )
| A. | 食盐中阴离子的结构示意图为  | |
| B. | 氧化亚铁溶于足量稀硝酸的离子方程式:FeO+2H+=Fe2++H2O | |
| C. | NaHS水解的离子方程式:HS-十H20?H3O++S2- | |
| D. | 用惰性电极电解氯化钠溶液,阳极电极反应式:2Cl--2e-=Cl2↑ |
